题目内容
20.Cl2、漂白液在生产、生活中广泛用于杀菌、消毒.回答下列问题.用惰性电极电解饱和食盐水(无隔膜)可获得漂白液和H2,且漂白液的有效成分与H2的物质的量相等,则其有效成分为NaClO,家庭使用漂白液时,不宜直接接触铁制品,因其会加速铁的腐蚀,漂白液腐蚀铁的负极反应式为:Fe-2e-═Fe2-,则正极反应为2H++2e-=H2↑.
分析 用惰性电极电解饱和食盐水(无隔膜)可获得次氯酸钠和H2,次氯酸钠是漂白液的有效成分,在电解池中,负极是活泼金属,金属本身失电子,在正极上根据离子的放电顺序来书写电极反应式.
解答 解:用惰性电极电解饱和食盐水(无隔膜)可获得次氯酸钠和H2,次氯酸钠是漂白液的有效成分,在电解池中,负极是活泼金属Fe,该电极上是金属本身失电子,在正极上根据离子的放电顺序,应该是氢离子得电子的还原反应,电极反应为:2H++2e-=H2↑,故答案为:NaClO;2H++2e-=H2↑.
点评 本题考查学生电解池的工作原理以及电极反应的书写方法知识,属于综合知识的考查,注意知识的迁移和应用是关键,难度中等.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
10.化学是人类创造新物质的工具.下列各种物质的现代工业生产原理或过程的描述与事实不相符的是( )
| A. | 用电解法制取Na、Mg、Al | |
| B. | 电解熔融NaCl制Cl2 | |
| C. | 以硫或硫铁矿为原料通过接触法制硫酸 | |
| D. | 制硅:SiO2$→_{高温}^{C}$粗硅$→_{高温}^{Cl_{2}}$SiCl4$→_{高温}^{H_{2}}$高纯硅 |
8.少量铁粉与100mL 0.01mol/L的稀盐酸(足量)反应,反应速率太慢.为了加快此反应速率而不改变H2的总量,可使用如下方法中的:①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加CH3COONa固体 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用10mL 0.1mol/L盐酸 ⑨改用100mL0.1mol/L的稀硝酸( )
| A. | ①⑥⑦ | B. | ③⑤⑧⑨ | C. | ③⑦⑧ | D. | ③⑦⑧⑨ |
15.设NA为阿伏伽德罗常数,下列叙述错误的是( )
| A. | 等物质的量的N2和CO所含分子数不一定为NA | |
| B. | S.T.P下22.4L CH4所含电子数目为10NA | |
| C. | 1molF-含质子数与电子数之和为10NA | |
| D. | 1molOH-中所含中子数为8NA |
17.请将下列实验错误操作可能会引起的不良后果填在表格中.
| 实验 | 向试管中加锌粒 | 对量筒中液体读数 | 浓H2SO4 |
错误操作 |  |  |  |
不良后果 |
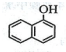 )的同分异构体,其分子中有两个官能团,能发生银镜反应,能被酸性KMnO4溶液氧化成G( C2H4O2)和芳香化合物H(C8H6O4),G和H与碳酸氢钠溶液反应均能放出CO2气体,H芳环上的一硝化产物只有一种.
)的同分异构体,其分子中有两个官能团,能发生银镜反应,能被酸性KMnO4溶液氧化成G( C2H4O2)和芳香化合物H(C8H6O4),G和H与碳酸氢钠溶液反应均能放出CO2气体,H芳环上的一硝化产物只有一种. ;
; +Cu2O↓+2H2O;
+Cu2O↓+2H2O; +HNO3(浓)$→_{△}^{浓硫酸}$
+HNO3(浓)$→_{△}^{浓硫酸}$ +H2O;
+H2O; .
.