题目内容
5.芳香化合物F是1-萘酚(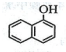 )的同分异构体,其分子中有两个官能团,能发生银镜反应,能被酸性KMnO4溶液氧化成G( C2H4O2)和芳香化合物H(C8H6O4),G和H与碳酸氢钠溶液反应均能放出CO2气体,H芳环上的一硝化产物只有一种.
)的同分异构体,其分子中有两个官能团,能发生银镜反应,能被酸性KMnO4溶液氧化成G( C2H4O2)和芳香化合物H(C8H6O4),G和H与碳酸氢钠溶液反应均能放出CO2气体,H芳环上的一硝化产物只有一种.(1)F的结构简式
 ;
;(2)F与新制氢氧化铜溶液的反应的方程式为
 +2Cu(OH)2$\stackrel{△}{→}$HOOC
+2Cu(OH)2$\stackrel{△}{→}$HOOC +Cu2O↓+2H2O;
+Cu2O↓+2H2O;(3)由H生成一硝化产物的化学方程式为
 +HNO3(浓)$→_{△}^{浓硫酸}$
+HNO3(浓)$→_{△}^{浓硫酸}$ +H2O;
+H2O;(4)该一硝产物的名称是2-硝基-1,4-苯二甲酸(或硝基对苯二甲酸).
分析 F是1-萘酚的同分异构体,其分子中有两个官能团,能发生银镜反应,则含-CHO;F能被KMnO4酸性溶液氧化成G(C2H4O2)和芳香化合物H(C8H6O4),G和H与碳酸氢钠溶液反应均能放出CO2气体,G、H均含-COOH,则F中含-C≡C-CH3,H芳环上的一硝化产物只有一种,H为对二苯甲酸,则F中-CHO、-C≡C-CH3在苯环的对位,以此来解答.
解答 解:F是1-萘酚的同分异构体,其分子中有两个官能团,能发生银镜反应,则含-CHO;能被KMnO4酸性溶液氧化成G(C2H4O2)和芳香化合物H(C8H6O4),G、H与碳酸氢钠溶液反应均能放出CO2气体,G、H均含-COOH,则F中含-C≡C-CH3,H芳环上的一硝化产物只有一种,G为对二苯甲酸( ),则F中-CHO、-C≡C-CH3在苯环的对位,所以F的结构简式为
),则F中-CHO、-C≡C-CH3在苯环的对位,所以F的结构简式为 ,由H生成的一硝化产物的化学方程式为
,由H生成的一硝化产物的化学方程式为 +HNO3(浓)$→_{△}^{浓硫酸}$
+HNO3(浓)$→_{△}^{浓硫酸}$ +H2O,生成有机物的名称为2-硝基-1,4-苯二甲酸(或硝基对苯二甲酸),
+H2O,生成有机物的名称为2-硝基-1,4-苯二甲酸(或硝基对苯二甲酸),
(1)以F的结构简式为 ,故答案为:
,故答案为: ;
;
(2)F和新制的氢氧化铜之间的反应为 +2Cu(OH)2$\stackrel{△}{→}$HOOC
+2Cu(OH)2$\stackrel{△}{→}$HOOC +Cu2O↓+2H2O,
+Cu2O↓+2H2O,
故答案为: +2Cu(OH)2$\stackrel{△}{→}$HOOC
+2Cu(OH)2$\stackrel{△}{→}$HOOC +Cu2O↓+2H2O;
+Cu2O↓+2H2O;
(3)由H生成的一硝化产物的化学方程式为 +HNO3(浓)$→_{△}^{浓硫酸}$
+HNO3(浓)$→_{△}^{浓硫酸}$ +H2O,
+H2O,
故答案为: +HNO3(浓)$→_{△}^{浓硫酸}$
+HNO3(浓)$→_{△}^{浓硫酸}$ +H2O;
+H2O;
(4)生成有机物 的名称为2-硝基-1,4-苯二甲酸(或硝基对苯二甲酸),故答案为:2-硝基-1,4-苯二甲酸(或硝基对苯二甲酸).
的名称为2-硝基-1,4-苯二甲酸(或硝基对苯二甲酸),故答案为:2-硝基-1,4-苯二甲酸(或硝基对苯二甲酸).
点评 本题为2014年广西高考化学试题的一部分,侧重有机合成的考查,把握合成流程中结构、官能团的变化为解答的关键,明确官能团与性质的关系、反应条件和反应类型的关系、同分异构体的推断即可解答,题目难度中等.

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案| A. | 丁达尔效应是溶液和胶体的本质区别 | |
| B. | 碱性氧化物一定是金属氧化物 | |
| C. | 常用作水处理剂的KAl(SO4)2和漂白粉都是强电解质 | |
| D. | 232Th 转变成233U是化学变化,233U和235U的化学性质几乎相同 |
| A. | 常温下,22g CO2含有2NA个氧原子 | |
| B. | 标准状况下,22.4L的CCl4中含有的分子数为NA | |
| C. | 1mol/L的碳酸钠溶液中含Na+离子数为2NA | |
| D. | 常温下,将含0.1NA个HCl分子的氯化氢气体溶于水配成100mL溶液,所得溶液中C(H+)为1mol/L |
| A. | 2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑ | B. | H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl | ||
| C. | 2HCl+Zn═ZnCl2+H2↑ | D. | NaCl+AgNO3═AgCl↓+NaNO3 |


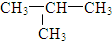 D.
D. 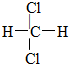 和
和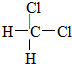 E.甲烷和庚烷
E.甲烷和庚烷