题目内容
【题目】室温下,下列说法中正确的是
A.室温下,盐酸中c(Cl-)与醋酸溶液中c(CH3COO-)相等,则两溶液的pH相等
B.将amol·L-1的醋酸溶液与0.01mol·L-1的氢氧化钠溶液等体积混合,溶液中:c(Na+)=c(CH3COO-),则醋酸的电离常数K=![]() (用含a的代数式表示)
(用含a的代数式表示)
C.向NH4Cl溶液中加入少量等物质的量浓度的稀盐酸,则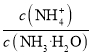 的值减小
的值减小
D.向Na[Al(OH)4]溶液中逐滴加入稀盐酸至沉淀恰好消失时:c(Cl-)=3c(Al3+)
【答案】A
【解析】
A.由电荷守恒可知,c(H+)=c(Cl-)+c(OH-),c(H+)=c(CH3COO-)+c(OH-),当两种溶液的c(Cl-)=c(CH3COO-)时,两种溶液中c(H+)相同,则两溶液的pH相等,故A正确;
B.由电荷守恒可知c(Na+)+c(H+)=c(OH-)+c(CH3COO-),已知溶液中c(CH3COO-)=c(Na+),则c(H+)=c(OH-),溶液显中性,即c(H+)=c(OH-)=10-7mol/L,c(CH3COO-)=c(Na+)=0.005mol·L-1,根据物料守恒知c(CH3COOH)=![]() ,用含a的代数式表示CH3COOH的电离常数K=
,用含a的代数式表示CH3COOH的电离常数K=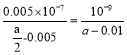 ,B项错误;
,B项错误;
C.温度不变,Kb=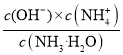 不变,向NH4Cl溶液中加入少量等浓度的稀盐酸,溶液中氢离子浓度增大,c(OH-)减小,则c(
不变,向NH4Cl溶液中加入少量等浓度的稀盐酸,溶液中氢离子浓度增大,c(OH-)减小,则c(![]() )/c(NH3H2O)的值将增大,C项错误;
)/c(NH3H2O)的值将增大,C项错误;
D.向Na[Al(OH)4]溶液中逐滴加入稀盐酸至沉淀恰好消失时,溶液中依次发生的反应为Na[Al(OH)4]+HCl=H2O+NaCl+Al(OH)3↓和Al(OH)3+3HCl=A1Cl3+3H2O,同时铝离子发生水解,则溶液中c(C1-)![]() 4c(A13+),D项错误;
4c(A13+),D项错误;
故选A。

【题目】下表列出了5种元素在周期表中的位置。
| ⅠA | 0 | ||||||
1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ |
(1)①的元素符号是________,⑤的原结构示意图是________________;
(2)以上元素中,金属性最强的是________________(填元素符号);
(3)④元素的最高价氧化物对应的水化物呈________性(填“酸”或“碱”或“两”);
(4)③④⑤三种元素按原子半径由大到小的顺序是__________(填元素符号);
(5)元素③与元素⑤形成的化合物的名称是________________;
(6)少量元素③的单质通常保存在________中(填“煤油”或“水”);
(7)元素①与元素②的单质氧化性较强的是________(填化学式)。
【题目】碳酸钠是重要的化工原料之一,广泛应用于轻工日化、建材、食品工业等行业。
(1)市售碳酸钠中含有氯化钠杂质,选用下列试剂设计实验方案进行检验,试剂:稀H2 SO4、BaCl2溶液、Ca(NO3)2溶液、AgNO3溶液
实验步骤 | 现 象 |
①取少量样品,加蒸馏水溶解 | ②固体完全溶解得到无色澄清溶液 |
③_____ | ④有白色沉淀生成 |
⑤静置,________ | ⑥ ________ |
(2)用AgNO3标准溶液滴定Cl-(以K2CrO4溶液为指示剂,Ag2CrO4为砖红色沉淀),来测定碳酸钠的纯度。
①配制样品溶液:称取某碳酸钠样品mg,用容量瓶配制100 mL溶液,定容时,用____加蒸馏水至刻度线。
②配制AgNO3溶液及浓度标定:称取AgNO3晶体8.5 g于烧杯中,用____取500 mL水并倒入烧杯中,搅拌摇匀后,转入____色试剂瓶,置于暗处、备用。用NaCl标准溶液标定上述AgNO3溶液浓度为b mol/L。
③滴定样品:取样品溶液20. 00 mL于锥形瓶中,加过量稀HNO3,滴入2~3滴K2 CrO4溶液,用AgNO3标准溶液滴定,滴定终点的现象为_________。
重复上述操作三次。四次测定数据如下表:
实验序号 | 1 | 2 | 3 | 4 |
消耗AgNO3溶液体积/mL | 20.00 | 21. 55 | 20. 02 | 19. 98 |
若在滴定终点读取滴定管刻度时俯视标准液液面,则测定结果____(填“偏高”、“偏低”或“无影响”);样品的纯度为____%。
【题目】下列操作对应的现象和离子方程式均正确的是( )
操作 | 现象 | 离子方程式 | |
A | 饱和碳酸钠溶液中通入过量CO2 | 无明显变化 | CO |
B | 向苏打溶液溶液中滴加稀硫酸 | 立即产生气泡 | CO |
C | 向Ba(OH)2溶液中加足量NaHCO3溶液 | 生成白色沉淀 | 2HCO |
D | 向NaHCO3溶液中加入少量偏铝酸钠 | 生成白色沉淀和无色气体 | HCO |
A.AB.BC.CD.D
【题目】298 K时,![]() γ-羟基丁酸水溶液发生如下反应,生成
γ-羟基丁酸水溶液发生如下反应,生成![]() 丁内酯: HOCH2CH2CH2COOH
丁内酯: HOCH2CH2CH2COOH![]()
![]() +H2O
+H2O
不同时刻测得![]() 丁内酯的浓度如下表。
丁内酯的浓度如下表。
| 20 | 50 | 80 | 100 | 120 | 160 | 220 | ∞ |
| 0.024 | 0.050 | 0.071 | 0.081 | 0.090 | 0.104 | 0.116 | 0.132 |
注:该条件下副反应、溶液体积变化忽略不计。下列分析正确的是
A.增大γ-羟基丁酸的浓度可提高γ-丁内酯的产率
B.298 K时,该反应的平衡常数为2.75
C.反应至120 min时,γ-羟基丁酸的转化率<50%
D.80~120 min的平均反应速率:v(γ-丁内酯) >1.2×10-3 mol L-1min-1