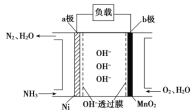
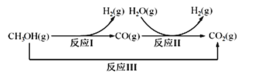
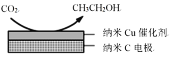
题目内容
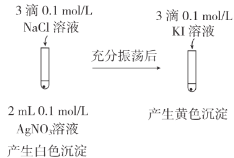
【题目】下列有关物质的鉴别或检验错误的是
A.用激光笔照射区别食盐水和蛋白质溶液
B.向溶液中滴入铁氰化钾溶液,可检验溶液中是否存在Fe2+
C.将红色石蕊试纸伸到集气瓶口可检验瓶里是不是氨气
D.向溶液中滴入足量稀盐酸后再滴入氯化钡溶液,可检验溶液中是否存在SO![]()
【答案】C
【解析】
A. 食盐水属于溶液,而蛋白质溶液属于胶体,胶体有丁达尔效应而溶液没有,故可用激光笔照射区别食盐水和蛋白质溶液,A正确;
B. 铁氰化钾溶液可与Fe2+生成蓝色沉淀,这是Fe2+的特征反应,因此, 向溶液中滴入铁氰化钾溶液,可检验溶液中是否存在Fe2+,B正确;
C. 实验室通常将湿润的红色石蕊试纸检验氨气,湿润的红色石蕊试纸遇氨气变蓝,C错误;
D. 向溶液中滴入足量稀盐酸后可以排除可能存在的干扰离子,然后再滴入氯化钡溶液,可检验溶液中是否存在SO![]() ,若有则生成白色沉淀,D正确。
,若有则生成白色沉淀,D正确。
本题选C。

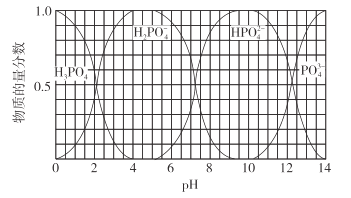
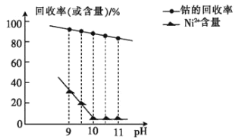
【题目】常温下,用含钴废料(主要成分为CoCO3,还含有少量NiCO3与铁屑)制备CoCl26H2O的工艺流程如图。
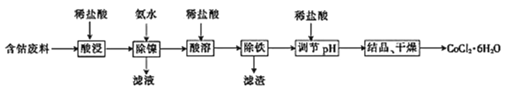
①已知除镍过程中溶液pH对钴的回收率及Ni2+含量的影响如图所示。
②部分金属阳离子在实验条件下开始沉淀和完全沉淀的pH如表所示:
金属阳离子 | 开始沉淀pH | 完全沉淀pH |
Fe3+ | 1.5 | 4.0 |
Fe2+ | 7.5 | 9.7 |
Co2+ | 6.6 | 9.4 |
Ni2+ | 7.7 | 9.5 |
回答下列问题:
(1)酸浸后溶液中的阳离子为:Co2+,Ni2+和__。
(2)除镍时,应调节溶液pH=__,此时Ni2+是否形成Ni(OH)2沉淀?___(是或否)。若pH过小,则产品纯度会___(升高,降低,或不变)。
(3)酸溶时,当调节pH=8时,溶液中n(Fe3+):n(Co2+)=__。
已知Ksp[Co(OH)2]=2.0×10-16,Ksp[Fe(OH)3]=4.0×10-38。
(4)除铁时先向溶液中加入30%的H2O2发生的离子反应方程式是:__。充分反应后再向溶液中加入CoCO3,调节溶液pH范围为__,使Fe3+完全转化为Fe(OH)3沉淀,最后过滤得到CoCl2溶液。
(5)已知Ag++SCN-=AgSCN↓,为测定粗产品中CoCl26H2O的含量,称取11.9g粗产品配成100mL溶液,从中取出25mL先加入含0.03mol的AgNO3,(杂质不与其反应),再用0.5mol/L的KSCN溶液标定过量的AgNO3,该标定操作所用的指示剂为__(填化学式),若消耗20.00mL的KSCN溶液,则该粗产品中CoCl26H2O的质量分数为__。
【题目】下列实验方案不能达到相应目的的是( )
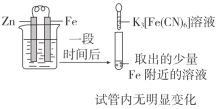
目的 | A.验证牺牲阳极的阴极保护法 | B.研究浓度对FeCl3水解平衡的影响 |
实验方案 |
|
|
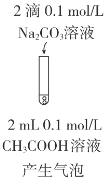
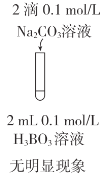
目的 | C.比较CH3COOH和H3BO3(硼酸)酸性的强弱 | D.比较AgCl和AgI溶解度的大小 |
实验方案 |
|
|
A.AB.BC.CD.D
【题目】碳酸钠是重要的化工原料之一,广泛应用于轻工日化、建材、食品工业等行业。
(1)市售碳酸钠中含有氯化钠杂质,选用下列试剂设计实验方案进行检验,试剂:稀H2 SO4、BaCl2溶液、Ca(NO3)2溶液、AgNO3溶液
实验步骤 | 现 象 |
①取少量样品,加蒸馏水溶解 | ②固体完全溶解得到无色澄清溶液 |
③_____ | ④有白色沉淀生成 |
⑤静置,________ | ⑥ ________ |
(2)用AgNO3标准溶液滴定Cl-(以K2CrO4溶液为指示剂,Ag2CrO4为砖红色沉淀),来测定碳酸钠的纯度。
①配制样品溶液:称取某碳酸钠样品mg,用容量瓶配制100 mL溶液,定容时,用____加蒸馏水至刻度线。
②配制AgNO3溶液及浓度标定:称取AgNO3晶体8.5 g于烧杯中,用____取500 mL水并倒入烧杯中,搅拌摇匀后,转入____色试剂瓶,置于暗处、备用。用NaCl标准溶液标定上述AgNO3溶液浓度为b mol/L。
③滴定样品:取样品溶液20. 00 mL于锥形瓶中,加过量稀HNO3,滴入2~3滴K2 CrO4溶液,用AgNO3标准溶液滴定,滴定终点的现象为_________。
重复上述操作三次。四次测定数据如下表:
实验序号 | 1 | 2 | 3 | 4 |
消耗AgNO3溶液体积/mL | 20.00 | 21. 55 | 20. 02 | 19. 98 |
若在滴定终点读取滴定管刻度时俯视标准液液面,则测定结果____(填“偏高”、“偏低”或“无影响”);样品的纯度为____%。
【题目】298 K时,![]() γ-羟基丁酸水溶液发生如下反应,生成
γ-羟基丁酸水溶液发生如下反应,生成![]() 丁内酯: HOCH2CH2CH2COOH
丁内酯: HOCH2CH2CH2COOH![]()
![]() +H2O
+H2O
不同时刻测得![]() 丁内酯的浓度如下表。
丁内酯的浓度如下表。
| 20 | 50 | 80 | 100 | 120 | 160 | 220 | ∞ |
| 0.024 | 0.050 | 0.071 | 0.081 | 0.090 | 0.104 | 0.116 | 0.132 |
注:该条件下副反应、溶液体积变化忽略不计。下列分析正确的是
A.增大γ-羟基丁酸的浓度可提高γ-丁内酯的产率
B.298 K时,该反应的平衡常数为2.75
C.反应至120 min时,γ-羟基丁酸的转化率<50%
D.80~120 min的平均反应速率:v(γ-丁内酯) >1.2×10-3 mol L-1min-1