题目内容
【题目】常温下,有关物质的溶度积如下,下列有关说法不正确的是( )
物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe(OH)3 |
Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.60×10-12 | 2.80×10-39 |
A.常温下,除去NaCl溶液中的MgCl2杂质,选用NaOH溶液比Na2CO3溶液效果好
B.常温下,除去NaCl溶液中的CaCl2杂质,选用NaOH溶液比Na2CO3溶液效果好
C.向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)=2.0×10-21
D.将适量的Ca(OH)2固体溶于100mL水中,刚好达到饱和[c(Ca2+)=1.0×10-2mol/L],若保持温度不变,向其中加入100mL0.012mol/L的NaOH,则该溶液变为不饱和溶液
【答案】B
【解析】
A.设镁离子的浓度为a,根据表格中的数据可知当产生Mg(OH)2沉淀时c(OHˉ)=![]() mol/L,当产生碳酸镁沉淀时,c(CO
mol/L,当产生碳酸镁沉淀时,c(CO![]() )=
)=![]() mol/L,
mol/L,![]() mol/L<
mol/L<![]() mol/L,所以当镁离子浓度相同时,氢氧化镁更容易产生沉淀,则除去NaCl溶液中的MgCl2杂质,选用NaOH溶液比Na2CO3溶液效果好,故A正确;
mol/L,所以当镁离子浓度相同时,氢氧化镁更容易产生沉淀,则除去NaCl溶液中的MgCl2杂质,选用NaOH溶液比Na2CO3溶液效果好,故A正确;
B.设钙离子离子的浓度为b,根据表格中的数据可知当产生Ca(OH)2沉淀时c(OHˉ)=![]() mol/L,当产生碳酸钙沉淀时,c(CO
mol/L,当产生碳酸钙沉淀时,c(CO![]() )=
)=![]() mol/L,
mol/L,![]() mol/L>
mol/L>![]() mol/L,所以当钙离子浓度相同时,碳酸钙更容易沉淀,则除去NaCl溶液中的CaCl2杂质,选用Na2CO3溶液比NaOH溶液效果好,故B错误;
mol/L,所以当钙离子浓度相同时,碳酸钙更容易沉淀,则除去NaCl溶液中的CaCl2杂质,选用Na2CO3溶液比NaOH溶液效果好,故B错误;
C.向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,![]() ,
,![]() ,所以
,所以![]() ,C项正确;
,C项正确;
D.将适量的Ca(OH)2固体溶于100mL水中,刚好达到饱和,c(Ca2+)=1.0×10-2mol/L,c(OH-)=![]() mol/L=2.163×10-2mol/L,若保持温度不变,向其中加入100mL 0.012mol/L的NaOH,混合后,c(Ca2+)=0.5×10-2mol/L,c(OH-)=
mol/L=2.163×10-2mol/L,若保持温度不变,向其中加入100mL 0.012mol/L的NaOH,混合后,c(Ca2+)=0.5×10-2mol/L,c(OH-)=![]() ,此时Ca(OH)2的离子积
,此时Ca(OH)2的离子积![]() <Ksp[Ca(OH)2],则该溶液变为不饱和溶液,D项正确;
<Ksp[Ca(OH)2],则该溶液变为不饱和溶液,D项正确;
综上所述答案为为B。

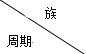
【题目】下表列出了5种元素在周期表中的位置。
| ⅠA | 0 | ||||||
1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ |
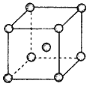
(1)①的元素符号是________,⑤的原结构示意图是________________;
(2)以上元素中,金属性最强的是________________(填元素符号);
(3)④元素的最高价氧化物对应的水化物呈________性(填“酸”或“碱”或“两”);
(4)③④⑤三种元素按原子半径由大到小的顺序是__________(填元素符号);
(5)元素③与元素⑤形成的化合物的名称是________________;
(6)少量元素③的单质通常保存在________中(填“煤油”或“水”);
(7)元素①与元素②的单质氧化性较强的是________(填化学式)。
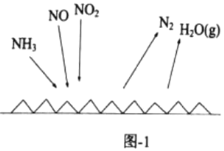
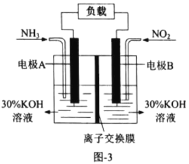
【题目】常温下,用含钴废料(主要成分为CoCO3,还含有少量NiCO3与铁屑)制备CoCl26H2O的工艺流程如图。
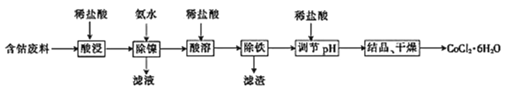
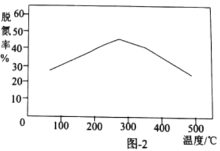
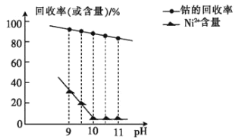
①已知除镍过程中溶液pH对钴的回收率及Ni2+含量的影响如图所示。
②部分金属阳离子在实验条件下开始沉淀和完全沉淀的pH如表所示:
金属阳离子 | 开始沉淀pH | 完全沉淀pH |
Fe3+ | 1.5 | 4.0 |
Fe2+ | 7.5 | 9.7 |
Co2+ | 6.6 | 9.4 |
Ni2+ | 7.7 | 9.5 |
回答下列问题:
(1)酸浸后溶液中的阳离子为:Co2+,Ni2+和__。
(2)除镍时,应调节溶液pH=__,此时Ni2+是否形成Ni(OH)2沉淀?___(是或否)。若pH过小,则产品纯度会___(升高,降低,或不变)。
(3)酸溶时,当调节pH=8时,溶液中n(Fe3+):n(Co2+)=__。
已知Ksp[Co(OH)2]=2.0×10-16,Ksp[Fe(OH)3]=4.0×10-38。
(4)除铁时先向溶液中加入30%的H2O2发生的离子反应方程式是:__。充分反应后再向溶液中加入CoCO3,调节溶液pH范围为__,使Fe3+完全转化为Fe(OH)3沉淀,最后过滤得到CoCl2溶液。
(5)已知Ag++SCN-=AgSCN↓,为测定粗产品中CoCl26H2O的含量,称取11.9g粗产品配成100mL溶液,从中取出25mL先加入含0.03mol的AgNO3,(杂质不与其反应),再用0.5mol/L的KSCN溶液标定过量的AgNO3,该标定操作所用的指示剂为__(填化学式),若消耗20.00mL的KSCN溶液,则该粗产品中CoCl26H2O的质量分数为__。
【题目】下列实验操作、现象和结论均正确的是( )
选项 | 实验操作 | 实验现象 | 结论 |
A | 将某有机物与溴的四氯化碳溶液混合 | 溶液褪色 | 该有机物中必定含有碳碳双键 |
B | 向亚硫酸钠溶液中滴加硝酸钡和稀硝酸 | 产生白色沉淀 | 亚硫酸钠溶液已变质 |
C | 向酸性高锰酸钾溶液中滴加双氧水 | 紫色褪去,产生气泡 | H2O2具有还原性 |
D | 向乙醇溶液中加一小块钠 | 产生气泡 | 乙醇含有羟基 |
A.AB.BC.CD.D