题目内容
14.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )| A. | 33.6L氟化氢中含有氟原子的数目为1.5NA | |
| B. | 常温常压下,7.0g乙烯与丙稀的混合物中含有氢原子的数目为NA | |
| C. | 50mL18.4 mol/L浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA | |
| D. | 某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA |
分析 A、HF所处的状态不明确;
B、根据乙烯和丙烯的最简式均为CH2来计算;
C、铜只能与浓硫酸反应,与稀硫酸不反应;
D、合成氨的反应为可逆反应.
解答 解:A、HF所处的状态不明确,故33.6LHF的物质的量不能计算,则分子个数不能计算,故A错误;
B、乙烯和丙烯的最简式均为CH2,故7.0g混合物中含有的CH2的物质的量n=$\frac{7.0g}{14g/mol}$=0.5mol,则含1mol氢原子即NA个,故B正确;
C、铜只能与浓硫酸反应,与稀硫酸不反应,故50mL18.4 mol/L浓硫酸一旦变稀则反应即停止,即浓硫酸不能反应完全,则生成的二氧化硫的分子数目小于0.46NA个,故C错误;
D、合成氨的反应为可逆反应,不能进行彻底,故0.1molN2和0.3molH2不能完全反应生成0.2mol氨气,则转移的电子的物质的量小于0.6mol,即小于0.6NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的运用和反应情况是解题关键,难度不大.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
10.下列物质中不能用来区分乙酸、乙醇、苯、四氯化碳的是( )
| A. | 溴水 | B. | 酸性髙锰酸钾溶液 | ||
| C. | 碳酸钠溶液 | D. | 紫色石蕊溶液 |
2.下列说法不正确的是( )
| A. | 硅是半导体材料,可用于制备光导纤维 | |
| B. | Na2O2能与CO2反应,可用作呼吸面具的供氧剂 | |
| C. | 明矾能水解生成Al(OH)3胶体,可用作净水剂 | |
| D. | Al2O3熔点高,可用于制作耐高温仪器 |
9.某盐是一种重要的化工原料,在印染、制革、木材和农业等领域有重要用途,其溶液可能含有NH4+、Al3+、SO42-、Fe2+、Cl-等若干种离子,某同学设计并完成了如下实验:
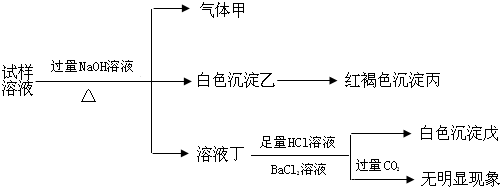
根据以上的实验操作与现象,该同学得出的结论不正确的是( )

根据以上的实验操作与现象,该同学得出的结论不正确的是( )
| A. | 试样中肯定有NH4+、SO42-和Fe2+ | |
| B. | 试样中一定没有Al3+ | |
| C. | 若气体甲在标准状况下体积为0.448L,沉淀丙和沉淀戊分别为1.07g和4.66g,则可判断溶液中还有Cl- | |
| D. | 该盐工业上可以用作净水剂 |
3.下列关于实验原理或操作的叙述中,正确的是( )
| A. | 吸入氯气、氯化氢气体时,可吸入少量酒精或乙醚的混合蒸气解毒 | |
| B. | 移液管放液时,将移液管稍倾斜放入直立的容器中,并使管尖与容器内壁接触,松开食指使溶液全部流出,数秒后,取出移液管 | |
| C. | 生物体死亡后,体内含有的碳-14会逐渐减少,因此可通过测量生物体遗骸中碳-14的含量,来计算它存活的年代.碳-14减少的变化为化学变化 | |
| D. | 当用电解法除去溶液中的Cr2O72-离子时,因其具有强氧化性易得电子,故可在阴极直接放电生成Cr3+,最后生成Cr(OH)3沉淀除去 |
4.可用于电动汽车的铝-空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极.下列说法正确的是( )
| A. | 以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-═4OH- | |
| B. | 以NaOH溶液为电解液时,负极区域的现象:先生成白色沉淀后逐渐溶解 | |
| C. | 以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变 | |
| D. | 电池工作时,电子通过外电路从正极流向负极 |
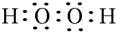 .W、X、Y的离子半径由大到小的顺序为S2->O2->Al3+(用离子符号回答)
.W、X、Y的离子半径由大到小的顺序为S2->O2->Al3+(用离子符号回答)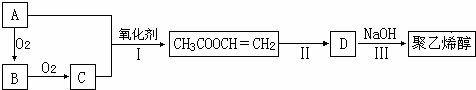
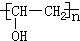 ;检验B常用的试剂为银氨溶液或新制氢氧化铜悬浊液;
;检验B常用的试剂为银氨溶液或新制氢氧化铜悬浊液; .
.