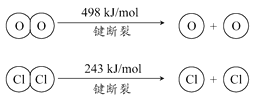
��Ŀ����
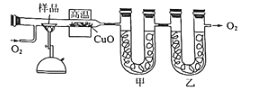
����Ŀ���ⶨ�л���������̼�������ɳ���ȼ�շ���������ͼ�ǵ¹���ѧ�����ϣ�ⶨ�л�����ɵ�װ�ã�����ͭ����������750������ʹ�л�������������ȫ������ΪCO2��H2O���ú��й����������ƺ��Ȼ��Ƶ����չֱܷ�����CO2��H2O��
�Իش��������⣺
(1)��װ����ʢ�ŵ�ҩƷ��______��
(2)��4.6g �л���A����ʵ�飬�������5.4gH2O��8.8gCO2����������и�Ԫ�ص�ԭ�Ӹ�������______��
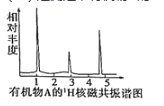
(3)���ⶨ���л���A��1H�˴Ź�������ͼ����A�Ľṹ��ʽΪ______��
���𰸡�CaCl2 N��C����N��H����N��O��=2��6��1 CH3CH2OH
��������
(1)����������ȫ������ΪCO2��H2O��ͨ���ⶨ���ɵ�CO2��H2O����ȷ��ʵ��ʽ�����Ȼ�������ˮ�������������������ն�����̼�����ڶ�����̼������ˮ�������������Ȼ�������ˮ���������������������ն�����̼������װ�����п�������Ӱ��ˮ������������̼�����ⶨ��ʵ�鿪ʼʱ��Ҫ��ͨ�������ž�װ���ڿ�����
(2)��������ˮ��������̼�����ʵ��������������غ��ж��Ƿ���OԪ�أ�������Ԫ�أ�����ԭ�����ʵ�����
(3)����ԭ����Ŀ֮��ȷ���л������ʽ�������ʽ��Hԭ���Ѿ�����C���ļ۽ṹ�������ʽ��Ϊ����ʽ��������Ҫ֪���л�����Է���������ȷ������ʽ���л���A�ĺ˴Ź���������3�����շ壬˵������3��Hԭ�ӡ�
(1)��Ϊ����������ͬʱ����CO2��H2O���Ӷ���ȷ������ˮ��CO2���������������Ȼ�������ˮ���������������������ն�����̼��
(2)����ˮ���ʵ���Ϊ![]() =0.3mol��Hԭ�����ʵ���Ϊ0.6mol�����ɶ�����̼Ϊ
=0.3mol��Hԭ�����ʵ���Ϊ0.6mol�����ɶ�����̼Ϊ![]() =0.2mol��̼ԭ�����ʵ���Ϊ0.2mol����ԭ�����ʵ���Ϊ4.6g0.6mol��1g/mol
=0.2mol��̼ԭ�����ʵ���Ϊ0.2mol����ԭ�����ʵ���Ϊ4.6g0.6mol��1g/mol![]() =0.1mol�����л���A��N(C):N(H):N(O)=0.2:0.6:0.1=2:6:1��
=0.1mol�������A��N(C):N(H):N(O)=0.2:0.6:0.1=2:6:1��
(3)�����л���A��ԭ�Ӹ�����N(C):N(H):N(O)=2:6:1��Hԭ���Ѿ�����̼���ļ۽ṹ�����л������ʽΪ��C2H6O���л���A�ĺ˴Ź���������3�����շ壬˵������3��Hԭ�ӣ����л���Ľṹ��ʽΪ��CH3CH2OH��

 ѧ�ڸ�ϰһ��ͨѧϰ�ܶ�Ա��ĩ������ӱ����������ϵ�д�
ѧ�ڸ�ϰһ��ͨѧϰ�ܶ�Ա��ĩ������ӱ����������ϵ�д� â���̸����������������ϵ�д�
â���̸����������������ϵ�д�����Ŀ�����º����£���2L�ܱ������м���MgSO4��s����CO��g����������Ӧ��MgSO4��s��+CO��g��MgO��s��+CO2��g��+SO2��g����Ӧ�����вⶨ�IJ������ݼ��±���
��Ӧʱ��/min | n��MgSO4��/mol | n��CO��/mol | n��CO2��/mol |
0 | 2.00 | 2.00 | 0 |
2 | 0.80 | ||
4 | 1.20 |
����˵����ȷ���ǣ�������
A.��Ӧ��0��2min�ڵ�ƽ������Ϊv��SO2��=0.6molL-1min-1
B.��Ӧ��2��4min��������������ܶ�û�б仯
C.�������¶ȣ���Ӧ��ƽ�ⳣ����Ϊ1.00��������ӦΪ���ȷ�Ӧ
D.���������������䣬��ʼʱ�������г���1.00molMgSO4��1.00molCO������ƽ��ʱn��CO2����0.60mol
����Ŀ��ij�����ijɷ�ΪCu2O��Al2O3��Fe2O3��SiO2����ҵ���øÿ�����ȡͭ�͵����IJ���������ͼ��

��֪����Cu2O��2H+=Cu��Cu2+��H2O��
�ڲ���������������������ʽ����ʱ��Һ��pH���±���ʾ��
������ | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
��ʼ����pH | 5.4 | 4.0 | 2.7 | 5.8 |
������ȫpH | 6.7 | 5.2 | 3.7 | 8.8 |
��1��Ϊ�˼ӿ췴Ӧ������ʣ����Բ�ȡ�Ĵ�ʩ��__(��д1��)��
��2����������A�еijɷ���__��
��3����Ӧ����ɺ���Ԫ�صĴ�����ʽΪ__(�����ӷ���)����������ӳ��õķ���֮һ�ǣ�ȡ�����������ӵ���Һ���Թ��У��μӼ��κ���+3����Ԫ�ص��������Һ�����������.д���÷�Ӧ�����ӷ���ʽ__��
��4������1��Ҫ������__��__��__��ϴ��CuSO4��5H2O�ֲ�Ʒ�����ô���ˮϴ�����ñ�ˮϴ�ӡ�ԭ����__��
��5����NaClO��pH�������ɳ���B����������������Ϣ��������BΪ___���÷�Ӧ���������뻹ԭ�������ʵ���֮��Ϊ___��
��6����NaOH��pH�������ɳ���C����������������Ϣ����y�ķ�ΧΪ___��
����Ŀ����ҵ���ò��ᡰ���ܡ����ٹ��˲����ܵõ���ĸҺA��������Ҫ�������гɷ֣�
H2C2O4 | Co2+ | Cl- | |
����Ũ�� | 20.0g/L | 1.18g/L | 2.13g/L |
Ϊ����Ч��ȥĸҺA�в����Ĵ������ᣬһ�������������������ᣬװ�����£�
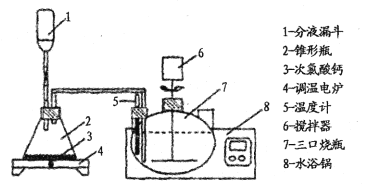
�ش��������⣺
(1)ĸҺA��c(CoO2)Ϊ____mol��L-1�� ��
(2)��Һ©����װ�����ᣬд����ȡ���������ӷ���ʽ ____________����Ӧ����ʹ�õ��µ�¯���ȣ�����ƿ��____(������)ʱֹͣ���ȡ�
(3)������ƿ��Ӧ�¶�Ϊ50����ˮԡ�����¶�Ӧ����Ϊ ____(�����)��
A.50�� B.5l-52�� C.45 - 55�� D.60��
(4)������������Ļ�ѧ����ʽΪ________ ��
(5)�������ܼӿ�����ȥ�����ʣ����������ʹ��������ȥ���ʷ������ͣ���Ҫԭ����__________��
(6)���ò���林�����ᡰ���ܡ������ŵ���____ ������Ҫȱ��Ϊ________��