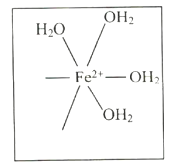
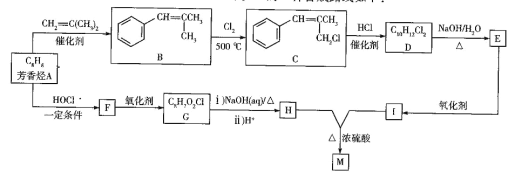
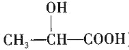
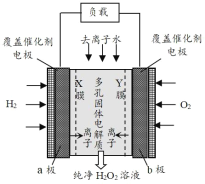
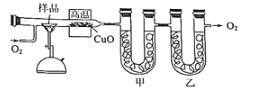
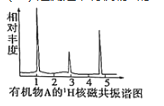
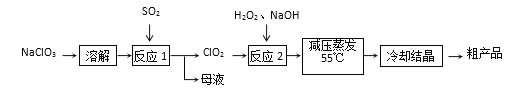
题目内容
【题目】恒温恒容下,向2L密闭容器中加入MgSO4(s)和CO(g),发生反应:MgSO4(s)+CO(g)MgO(s)+CO2(g)+SO2(g)反应过程中测定的部分数据见下表:
反应时间/min | n(MgSO4)/mol | n(CO)/mol | n(CO2)/mol |
0 | 2.00 | 2.00 | 0 |
2 | 0.80 | ||
4 | 1.20 |
下列说法正确的是( )
A.反应在0~2min内的平均速率为v(SO2)=0.6molL-1min-1
B.反应在2~4min内容器内气体的密度没有变化
C.若升高温度,反应的平衡常数变为1.00,则正反应为放热反应
D.保持其他条件不变,起始时向容器中充入1.00molMgSO4和1.00molCO,到达平衡时n(CO2)<0.60mol
【答案】B
【解析】
A.由表中数据,可知2min内,△n(CO)=2mol0.8mol=1.2mol,由方程式可知△n(SO2)=△n(CO)=1.2mol,则v(SO2)= =0.3mol/(L.min),故A错误;
=0.3mol/(L.min),故A错误;
B.2min时消耗CO为1.2mol,由方程式可知△n(CO2)=△n(CO)=1.2mol,4min时CO2为1.2mol,说明2min、4min处于平衡状态,故反应在24min内容器内气体的密度没有变化,故B正确;
C.平衡时c(SO2)=c(CO2)=![]() =0.6mol/L,c(CO)=
=0.6mol/L,c(CO)=![]() = 0.4mol/L,则平衡常数K=
= 0.4mol/L,则平衡常数K=![]() =0.9,若升高温度,反应的平衡常数变为1.00,大于原温度下平衡常数K=0.9,说明升高温度平衡正向移动,升高温度平衡向吸热反应移动,故正反应为吸热反应,故C错误;
=0.9,若升高温度,反应的平衡常数变为1.00,大于原温度下平衡常数K=0.9,说明升高温度平衡正向移动,升高温度平衡向吸热反应移动,故正反应为吸热反应,故C错误;
D.保持其他条件不变,起始时向容器中充入1.00molMgSO4和1.00molCO,等效为在原平衡基础上体积增大一倍,减小压强,平衡正向移动,CO转化率大于原平衡,则到达平衡时n(CO2)>0.60mol,故D错误;
答案选B。

 名校课堂系列答案
名校课堂系列答案【题目】下表是![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 五种短周期元素的某些性质:
五种短周期元素的某些性质:
元素 | A | B | C | D | E |
最低负化合价 |
|
|
|
|
|
电负性 | 2.55 | 2.58 | 3.16 | 3.44 | 3.98 |
下列判断正确的是( )
A.![]() 、
、![]() 、
、![]() 的简单氢化物的稳定性:
的简单氢化物的稳定性:![]()
![]() 元素原子的最外层原子轨道中无自旋状态相同的电子
元素原子的最外层原子轨道中无自旋状态相同的电子
C.![]() 元素与
元素与![]() 元素不可能形成化合物
元素不可能形成化合物
D.与![]() 元素同周期的第一电离能最小的元素的单质能与
元素同周期的第一电离能最小的元素的单质能与![]() 发生置换反应
发生置换反应