题目内容
【题目】A、B、C、D、E、F为六种短周期元素,它们核电荷数依次递增。已知:B原子核外最外层电子数是次外层电子数的两倍,电子总数是E原子总数的1/2,F是同周期元素中原子半径最小的元素;D2﹣与E2+的电子层结构相同。B与D可以形成三原子化合物甲。A是非金属元素,且A、C、F可形成离子化合物乙。请回答:
(1)C单质的电子式_____,F元素原子的电子排布式_____,E元素的原子结构示意图是_____;
(2)化合物乙中含有的化学键是_____;
(3)化合物甲的结构式_____,固体时属于_____晶体。
【答案】 ![]() 1s22s22p63s23p5
1s22s22p63s23p5 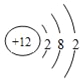 离子键、极性共价键、配位键 O=C=O 分子
离子键、极性共价键、配位键 O=C=O 分子
【解析】B原子核外最外层电子数是次外层电子数的两倍,应为C元素,电子总数是E原子总数的12,则E的原子序数为12,应为Mg元素,F是同周期元素中原子半径最小的元素,位于第三周期,应为Cl元素,D2-与E2+的电子层结构相同,则D应为O,由此可知C为N元素,A是非金属元素,且A、C、F可形成离子化合物乙,可知A为H元素,乙为氯化铵。(1)由以上分析可知C为N元素,单质的电子式为![]() ,F为Cl元素,电子排布式为1s22s22p63s23p5,E为Mg元素,原子核外有3个电子层,最外层电子数为2,原子结构示意图为
,F为Cl元素,电子排布式为1s22s22p63s23p5,E为Mg元素,原子核外有3个电子层,最外层电子数为2,原子结构示意图为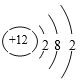 ;(2)乙为氯化铵,为离子化合物,含有离子键、共价键和配位键;(3)C与O可以形成三原子化合物甲,为CO2,其结构式为O=C=O,固体时属于分子晶体。
;(2)乙为氯化铵,为离子化合物,含有离子键、共价键和配位键;(3)C与O可以形成三原子化合物甲,为CO2,其结构式为O=C=O,固体时属于分子晶体。

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
