题目内容
【题目】填空题。请完成以下有关计算:
(1)标准状况下,m g A气体与n g B气体分子数相等,25℃时,1 kg气体A与1 kg气体B的分子数之比为________ 。
(2)m g某M溶于盐酸中,放出的气体在标准状况下的体积为n L,并生成氯化物MCl2,则金属M的相对原子质量是________。
(3)如图有三只气球,其中VA=VB=1.12 L。
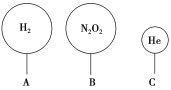
①A、B中气体的物质的量____(填“一定”或“不一定”)是0.05 mol。
②标准状况下,A、B气球中的分子个数比为_________。
③相同温度和压强下,A、C气球中气体的质量相等,则V(A)∶V(C)=__________
(4)取100 mL 0.3 mol·L-1和300 mL 0.25 mol·L-1的硫酸注入500 mL容量瓶中,加水稀释至刻度线,该混合溶液中H+的物质的量浓度是________。
【答案】n∶m 22.4m/n 不一定 1∶1 2∶1 0.42 mol·L-1
【解析】
(1)由n=![]() 可知,相同质量时分子数与摩尔质量成反比;
可知,相同质量时分子数与摩尔质量成反比;
(2)M的氯化物的化学式为MCl2,即M元素的化合价为+2价;根据化学反应方程式:M+2HCl=MCl2+H2可以求解;
(3) ①题干中没有说明是标准状态下,不能用22.4L/mol计算气体体积;
②同温同压时,体积相同的气体物质的量相等;
③相同温度和压强下,气体的体积之比等于物质的量之比;
(4)令混合后溶质硫酸的物质的量浓度为a,则:100mL×0.3mol L-1+300mL×0.25mol L-1=500mL×a。
(1) 由n=![]() 可知,相同质量时分子数与摩尔质量成反比,所以1kg气体A与1kg气体B的分子数之比为n∶m;
可知,相同质量时分子数与摩尔质量成反比,所以1kg气体A与1kg气体B的分子数之比为n∶m;
(2) M的氯化物的化学式为MCl2,即M元素的化合价为+2价;根据化学反应方程式:M+2HCl=MCl2+H2,n(M)=n(H2)= ![]() ,可得金属M的相对原子质量是
,可得金属M的相对原子质量是![]() =
= 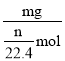 =22.4
=22.4![]() ;
;
(3) ①题干中没有说明是标准状态下,不能用22.4L/mol计算气体体积,A、B中气体的体积VA=VB=1.12 L,不一定是0.05 mol;
②同温同压时,体积相同的气体物质的量相等,VA=VB=1.12 L,故n(A)=n(B),A、B气球中的分子个数比为1∶1;
③相同温度和压强下,气体的体积之比等于物质的量之比,A、C气球中气体的质量相等,则V(A)∶V(C)= ![]() =
= ![]() =
= ![]() =
= ![]() =2∶1;
=2∶1;
(4) 令混合后溶质硫酸的物质的量浓度为a,则:100mL×0.3mol L-1+300mL×0.25mol L-1=500mL×a,解得:a=0.21mol/L,混合稀释后溶液中c(H+)=2n(H2SO4)=2×0.21mol/L=0.42mol/L。

【题目】已知化学反应①:Fe(s)+CO2(g)![]() FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)![]() FeO(s)+H2(g),其平衡常数为K2,化学反应③CO2(g)+H2(g)
FeO(s)+H2(g),其平衡常数为K2,化学反应③CO2(g)+H2(g)![]() H2O(g)+CO(g),其平衡常数为K3,在温度为973K和1173K情况下,K1、K2的值分别如下:
H2O(g)+CO(g),其平衡常数为K3,在温度为973K和1173K情况下,K1、K2的值分别如下:
温度 | K1 | K2 |
973 K | 1.47 | 2.38 |
1173 K | 2.15 | 1.67 |
请填空:
(1)通过表格中的数值可以推断:反应①是____(填“吸热”或“放热”)反应。
(2)根据反应①与②可推导出K1、K2与K3之间的关系式_____,据此关系式及上表数据,也能推断出反应③是____(填“吸热”或“放热”)反应。
(3)要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有____。
A.缩小反应容器的容积
B.扩大反应容器的容积
C.升高温度
D.使用合适的催化剂
E.设法减小平衡体系中CO的浓度
(4)图甲、图乙分别表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:

①图甲t2时刻改变的条件是___。②图乙t2时刻改变的条件是__。
【题目】下表所列各组物质中,物质之间通过一步反应能实现如图所示转化的是( )
X | Y | Z | 物质转化关系 | |
A | Cu | CuO | Cu(OH)2 |
|
B | Si | SiO2 | H2SiO3 | |
C | NaHCO3 | Na2CO3 | NaOH | |
D | FeCl2 | FeO | FeCl3 |
A. A B. B C. C D. D
【题目】工业生产中常用炼锌废渣(含有ZnO、FeO、Fe2O3、CuO等杂质)来提取氧化锌和金属铜等,其主要工艺流程如图所示:
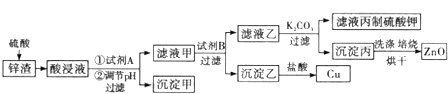
有关氢氧化物开始沉淀和沉淀完全的pH见下表
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 5.4 | 6.5 |
沉淀完全的pH | 3.7 | 9.7 | 6.7 | 8.0 |
(1)为提高浸出速率,除适当增加硫酸浓度外,还可采取的措施有(写出两条) ______
(2)试剂A是 ______ (填化学式).
(3)调节酸浸液的pH的范围是 ______.
(4)滤液甲与试剂B发生置换反应,则试剂B是 ______ (填化学式).
(5)在实验室进行焙烧时,盛放沉淀丙的仪器名称是 ______ .


