题目内容
【题目】工业上用赤铁矿(含Fe2O3、FeO,也含有Al2O3、MnO2、CuO等)制备FeSO4·7H2O(绿矾)的流程如下:
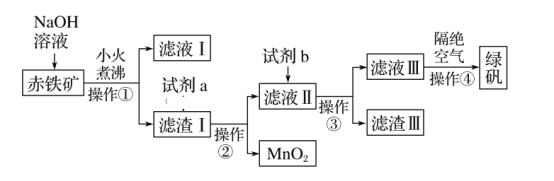
(1)实验室中操作①的名称为____。所需的玻璃仪器有烧杯、______、_____。
(2)氢氧化钠溶液加入赤铁矿中发生反应的离子方程式为_______________________。
(3)加入滤渣Ⅰ中的试剂a是___________,滤液Ⅱ中的主要金属阳离子有_____。
(4)试剂b为__________________。
(5)滤渣Ⅲ中的主要成分是____________。操作④隔绝空气的目的是___________。
【答案】过滤 漏斗 玻璃棒 Al2O3+2OH-===2AlO![]() +H2O 硫酸(或H2SO4) Fe3+、Fe2+、Cu2+ Fe Cu、Fe 防止溶液中的Fe2+被空气氧化为Fe3+
+H2O 硫酸(或H2SO4) Fe3+、Fe2+、Cu2+ Fe Cu、Fe 防止溶液中的Fe2+被空气氧化为Fe3+
【解析】
赤铁矿(含Fe2O3、FeO,也含有Al2O3、MnO2、CuO等),由制备流程可知,加NaOH后,Al2O3与NaOH反应,则滤液I中含OH-、AlO2-,滤渣I中含Fe2O3、FeO、MnO2、CuO,加试剂a为硫酸,操作①②均为过滤,滤液Ⅱ中含硫酸、Fe2(SO4)3、FeSO4、CuSO4,试剂b为Fe,操作③为过滤,滤渣Ⅲ为Cu、Fe,滤液Ⅲ含FeSO4,蒸发浓缩、冷却结晶得到绿矾,以此来解答。
(1)操作①的目的为固液分离,则操作名称为过滤,该操作所需的玻璃仪器有烧杯、漏斗、玻璃棒;
(2) NaOH溶液加入赤铁矿中,氧化铝溶于NaOH溶液生成NaAlO2和水,发生反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O;
(3) 试剂a为硫酸,溶解Fe2O3、FeO和CuO,,则滤液Ⅱ中的主要金属阳离子有Fe3+、Fe2+和Cu2+;
(4)加入试剂b的目的是将Fe3+还原为Fe2+,同时除去Cu2+,则在不引入新的杂质的基础上,试剂b应选择Fe;
(5)在含有Fe3+、Fe2+和Cu2+的溶液中加入过量铁粉,将Fe3+还原为Fe2+,同时除去Cu2+,则过滤所得滤渣Ⅲ中的主要成分是Fe、Cu;亚铁离子不稳定,易被空气氧化生成铁离子,所以操作④隔绝空气的目的是防止溶液中的Fe2+被空气氧化为Fe3+。

【题目】下表所列各组物质中,物质之间通过一步反应能实现如图所示转化的是( )
X | Y | Z | 物质转化关系 | |
A | Cu | CuO | Cu(OH)2 |
|
B | Si | SiO2 | H2SiO3 | |
C | NaHCO3 | Na2CO3 | NaOH | |
D | FeCl2 | FeO | FeCl3 |
A. A B. B C. C D. D
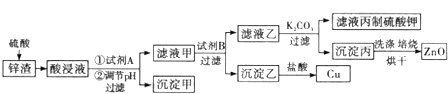
【题目】工业生产中常用炼锌废渣(含有ZnO、FeO、Fe2O3、CuO等杂质)来提取氧化锌和金属铜等,其主要工艺流程如图所示:
有关氢氧化物开始沉淀和沉淀完全的pH见下表
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 5.4 | 6.5 |
沉淀完全的pH | 3.7 | 9.7 | 6.7 | 8.0 |
(1)为提高浸出速率,除适当增加硫酸浓度外,还可采取的措施有(写出两条) ______
(2)试剂A是 ______ (填化学式).
(3)调节酸浸液的pH的范围是 ______.
(4)滤液甲与试剂B发生置换反应,则试剂B是 ______ (填化学式).
(5)在实验室进行焙烧时,盛放沉淀丙的仪器名称是 ______ .