题目内容
【题目】MgCO3和CaCO3的能量关系如图所示(M=Ca、Mg):
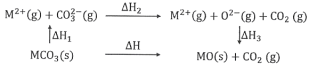
下列说法正确的是
A.△H1(CaCO3)>△H1(MgCO3)>0
B.△H2(MgCO3)>△H2(CaCO3)>0
C.△H1(CaCO3)-△H1(MgCO3)=△H3(CaO)-△H3(MgO)
D.对于MgCO3和CaCO3,△H1+△H2>△H3
【答案】D
【解析】
A.Ca2+的半径比Mg2+大,则CaCO3电离时需要的能量比MgCO3小,且电离过程是吸热过程,则△H1(MgCO3)>△H1(CaCO3)> 0
B.MgCO3和CaCO3中CO32-(g)=O2-(g)+CO2(g)所需要的能量相等,则△H2(MgCO3)=△H2(CaCO3)>0,故B错误;
C.由△H1(MgCO3)>△H1(CaCO3)> 0知△H1(CaCO3)-△H1(MgCO3)<0;Ca2+的半径比Mg2+大,形成CaO释放的热量小于形成MgO释放的热量,即△H3(CaO)-△H3(MgO)> 0,则△H1(CaCO3)-△H1(MgCO3)<△H3(CaO)-△H3(MgO),故C错误;
D.电离和断裂化学键是吸热过程,则△H1+△H2>0,形成化学键是放热过程,△H3<0,则△H1+△H2>△H3,故D正确;
故答案为D。

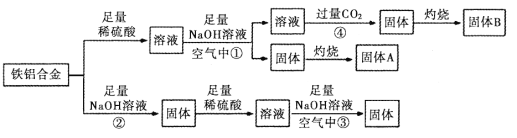
【题目】工业生产中常用炼锌废渣(含有ZnO、FeO、Fe2O3、CuO等杂质)来提取氧化锌和金属铜等,其主要工艺流程如图所示:
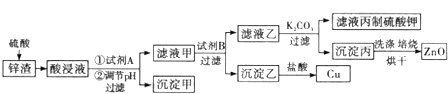
有关氢氧化物开始沉淀和沉淀完全的pH见下表
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 5.4 | 6.5 |
沉淀完全的pH | 3.7 | 9.7 | 6.7 | 8.0 |
(1)为提高浸出速率,除适当增加硫酸浓度外,还可采取的措施有(写出两条) ______
(2)试剂A是 ______ (填化学式).
(3)调节酸浸液的pH的范围是 ______.
(4)滤液甲与试剂B发生置换反应,则试剂B是 ______ (填化学式).
(5)在实验室进行焙烧时,盛放沉淀丙的仪器名称是 ______ .