题目内容
【题目】所谓手性分子是指在分子中,当一个碳原子上连有彼此互不相同的四个原子或原子团时,称此分子为手性分子,中心碳原子为手性碳原子。凡是有一个手性碳原子的物质一定具有光学活性。例如,有机化合物![]() 有光学活性。则该有机化合物分别发生如下反应后,生成的有机物仍有光学活性的是( )
有光学活性。则该有机化合物分别发生如下反应后,生成的有机物仍有光学活性的是( )
A. 与乙酸发生酯化反应
B. 与NaOH水溶液共热
C. 与银氨溶液作用
D. 在催化剂存在下与氢气作用
【答案】C
【解析】
A.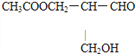 与乙酸发生酯化反应,反应后生成的物质中C原子上连接两个相同的CH3COOCH2-原子团,不具有光学活性,故A错误;B.
与乙酸发生酯化反应,反应后生成的物质中C原子上连接两个相同的CH3COOCH2-原子团,不具有光学活性,故A错误;B.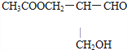 与NaOH溶液共热发生水解,反应后生成的物质中C原子上连接两个相同的-CH2OH原子团,不具有光学活性,故B错误;C.
与NaOH溶液共热发生水解,反应后生成的物质中C原子上连接两个相同的-CH2OH原子团,不具有光学活性,故B错误;C.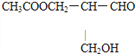 与银氨溶液作用被氧化,-CHO生成-COOH,C原子仍连接4个不同的原子或原子团,具有光学活性,故C正确;D.
与银氨溶液作用被氧化,-CHO生成-COOH,C原子仍连接4个不同的原子或原子团,具有光学活性,故C正确;D.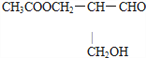 在催化剂存在下与H2作用,-CHO生成-CH2OH,反应后生成的物质中C原子上连接两个相同的-CH2OH原子团,不具有光学活性,故D错误;故选C。
在催化剂存在下与H2作用,-CHO生成-CH2OH,反应后生成的物质中C原子上连接两个相同的-CH2OH原子团,不具有光学活性,故D错误;故选C。

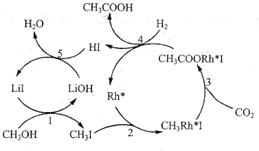
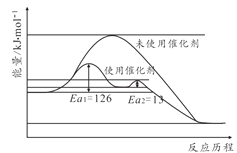
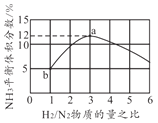
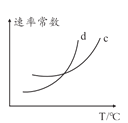
【题目】合成氨对人类的生存和发展有着重要意义,1909年哈伯在实验室中首次利用氮气与氢气反应合成氨,实现了人工固氮。
(1)反应N2(g) + 3H2(g) ![]() 2NH3(g)的化学平衡常数表达式为______。
2NH3(g)的化学平衡常数表达式为______。
(2)请结合下列数据分析,工业上选用氮气与氢气反应固氮,而没有选用氮气和氧气反
应固氮的原因是______。
序号 | 化学反应 | K(298K)的数值 |
① | N2(g) + O2(g) | 5×10-31 |
② | N2(g) + 3H2(g) | 4.1×106 |
(3)对于反应N2(g)+3H2(g)![]() 2NH3(g),在一定条件下氨的平衡含量如下表。
2NH3(g),在一定条件下氨的平衡含量如下表。
温度/℃ | 压强/MPa | 氨的平衡含量 |
200 | 10 | 81.5% |
550 | 10 | 8.25% |
① 该反应为______(填“吸热”或“放热”)反应。
② 其他条件不变时,温度升高氨的平衡含量减小的原因是______(填字母序号)。
a. 温度升高,正反应速率减小,逆反应速率增大,平衡逆向移动
b. 温度升高,浓度商(Q)变大,Q > K,平衡逆向移动
c. 温度升高,活化分子数增多,反应速率加快
d. 温度升高,K变小,平衡逆向移动
③ 哈伯选用的条件是550℃、10 MPa,而非200℃、10 MPa,可能的原因是______。
(4)一定温度下,在容积恒定的密闭容器中充入1 mol 氮气和3 mol氢气,一段时间后达化学平衡状态。若保持其他条件不变,向上述平衡体系中再充入1 mol氮气和3 mol 氢气,氮气的平衡转化率______(填“变大”“变小”或“不变”)。
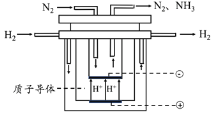
(5)尽管哈伯的合成氨法被评为“20世纪科学领域中最辉煌的成就”之一,但仍存在耗能高、产率低等问题。因此,科学家在持续探索,寻求合成氨的新路径。下图为电解法合成氨的原理示意图,阴极的电极反应式为______。
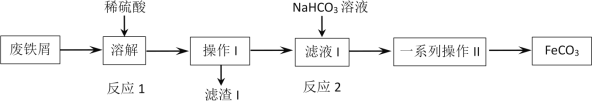
【题目】Ⅰ. 实验室制得气体中常含有杂质,影响其性质检验。
下图A为除杂装置,B为性质检验装置,完成下列表格:

序号 | 气体 | 反应原理 | A中试剂 |
① | 乙烯 | 溴乙烷和NaOH的醇溶液加热 | _____________ |
② | 乙烯 | 无水乙醇在浓硫酸的作用下加热至170℃反应的化学方程式是_________________ | ___________ |
③ | 乙炔 | 电石与饱和食盐水反应 | _______________ |
Ⅱ. 为探究乙酸乙酯的水解情况,某同学取大小相同的3支试管,分别加入以下溶液,充分振荡,放在同一水浴加热相同时间,观察到如下现象。
编号 | ① | ② | ③ |
实验操作 |
|
|
|
实验现象 | 酯层变薄 | 酯层消失 | 酯层基本不变 |
(1)试管①中反应的化学方程式是________________________;
(2)对比试管①和试管③的实验现象,稀H2SO4的作用是______________;
(3)试用化学平衡移动原理解释试管②中酯层消失的原因_____________。