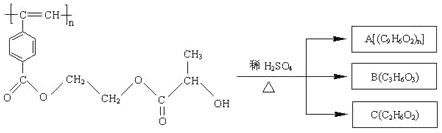
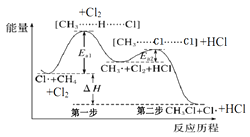
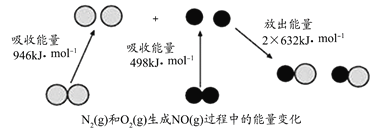
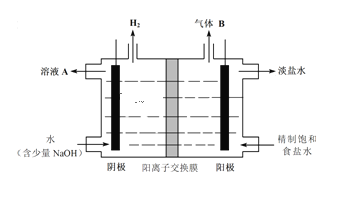
��Ŀ����
����Ŀ��ijͬѧ���÷���м(��Ҫ�ɷ�ΪFe2O3��Fe������̼) ��ȡ̼��������FeCO3�� ��������������̣�
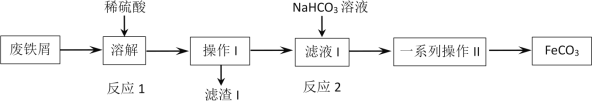
������������ͼ������˵������ȷ���ǣ� ��
A.��ҵ����м������������֬����ͨ���ȱ���̼������Һϴ�ӳ�ȥ
B.��Ӧ2�����ӷ���ʽ��Fe2++HCO3- = FeCO3��+H+
C.����IΪ���ˣ�ϴ�Ӳ�����һϵ�в���IIΪ���ˣ�ϴ�ӣ�����
D.Ϊ���������ܽ�ʱFe2+����������������мӦ�ʵ�����
���𰸡�B
��������
���ܽ⡱�Σ�Fe2O3�����ᷴӦ����Fe2(SO4)3��ˮ��Fe��Fe2(SO4)3��ӦFeSO4��Fe��H2SO4��Ӧ����FeSO4��������FeԪ����Fe2+��������Һ�С�������Ϊ���ˣ���ȥδ��Ӧ��C����Һ1�м�NaHCO3��HCO3-��Fe2+��Ӧ����FeCO3������ͨ�����ˡ�ϴ�ӡ������һϵ�в����õ�FeCO3���ݴ˽��
A��̼����ˮ��ʼ��ԣ���֬�ڼ��Ի�����ˮ�⣬�¶����ߣ�ˮ��̶����ʹ�ҵ����м������������֬����ͨ���ȱ���̼������Һϴ�ӳ�ȥ��A��ȷ��
B����ϵ���غ�ɵ÷�Ӧ2�����ӷ���ʽΪ��Fe2++2HCO3-=FeCO3��+H2O+CO2����B����
C������IΪ���˳�ȥC��Ϊ����Fe2+����ʧ������ϴ�Ӳ�����Ϊ�õ�������FeCO3��һϵ�в���IIΪ���ˡ�ϴ�ӡ����C��ȷ��
D��Fe2+�ױ������е�������������Ϊ���������ܽ�ʱFe2+����������������мӦ�ʵ�������D��ȷ��
��ѡB��

����Ŀ��Ni(CO)4�������л��ϳɣ�Ҳ������������һ�������£�һ���ݻ����ܱ������У�������Ӧ��Ni(s)+4CO(g)![]() Ni(CO)4(g)����֪�÷�Ӧƽ�ⳣ�����¶ȵĹ�ϵ���±���
Ni(CO)4(g)����֪�÷�Ӧƽ�ⳣ�����¶ȵĹ�ϵ���±���
�¶�/�� | 25 | 80 | 230 |
ƽ�ⳣ�� | 5��104 | 2 | 1.9��10-5 |
����˵����ȷ����
A. 25��ﵽƽ��ʱ���������м���ͨ��CO��Ni��ת��������COת���ʼ�С
B. �¶�Խ�ͣ�Խ������Ni(CO)4������
C. ��80��ʱ�����ijʱ�̣�Ni(CO)4��COŨ�Ⱦ�Ϊ0.5mol/L�����ʱv(��)��v(��)
D. ƽ��ʱ���ܱ������м����������ۣ�ƽ��������Ӧ�����ƶ�����ƽ��ʱCOŨ�ȱ�ԭƽ��С