题目内容
20.一定温度下,向2.0L恒容器中充入2molSO2和1molO2,发生反应:2SO2(g)+O2(g)?2SO3(g).经过一段时间后达到平衡,反应过程中测定的部分数据见下表,下列说法正确的是( )| t/s | 0 | t1 | t2 | t3 | t4 |
| n(SO3)/mol | 0 | 0.6 | 1.2 | 1.8 | 1.8 |
| A. | 反应在前t1s的平均速率v(O2)=0.3/t1 mol•L-1•s-1 | |
| B. | 该温度下反应平衡常数为1.62×10-3L/mol | |
| C. | 相同温度下,起始时向容器中充入4 mol SO3,达到平衡时,SO3的转化率大于10% | |
| D. | 温度不变,向该容器中再充入0.2molSO2、0.1 molO2,1.8molSO3,达到新平衡时SO3转化率升高 |
分析 A、根据公式v=$\frac{△c}{△t}$计算三氧化硫表示的反应速率,根据化学反应速率之比等于系数之比计算氧气的平均速率;
B、平衡常数只受温度的影响;
C、根据极限转化的思想,向容器中充入4mol SO3,相当于投入4mol二氧化硫和2mol氧气;
D、根据压强对化学反应速率的影响知识来回答判断.
解答 解:A、三氧化硫表示的反应速率v=$\frac{△c}{△t}$=$\frac{\frac{0.6mol}{2L}}{t{\;}_{1}}$=$\frac{0.3}{t{\;}_{1}}$mol•L-1•s-1,化学反应速率之比等于系数之比,氧气的平均速率为$\frac{1}{2}$×$\frac{0.3}{t{\;}_{1}}$mol•L-1•s-1,故A错误;
B、2SO2(g)+O2(g)?2SO3(g)
初起浓度:1 0.5 0
变化浓度:0.9 0.45 0.9
平衡浓度:0.1 0.05 0.9
所以K=$\frac{0.9{\;}^{2}}{0.1{\;}^{2}×0.05}$=1.62×103,故B错误;
C、相同温度下,起始时向容器中充入4mol SO3,根据极限转化的思想,向容器中充入4mol SO3,相当于投入4mol二氧化硫和2mol氧气,增加二氧化硫的量,会降低其转化率,故C错误;
D、温度不变,向该容器中再充入0.2 mol SO2、0.1 mol O2,1.8 mol SO3,增大了压强,平衡正向移动,三氧化硫的物质的量增加,所以反应达到新平衡时SO3转化率升高,故D正确.
故选D.
点评 本题考查学生化学反应速率的计算、化学平衡的移动等方面的知识,注意三行式在解题中的应用是关键,难度中等.

| A. | 元素周期表中,电子层数越多,半径一定越大 | |
| B. | 元素周期表中,同一主族,随着核电荷数的递增,熔沸点逐渐降低 | |
| C. | 非金属元素与非金属元素之间可能形成离子键 | |
| D. | 含有离子键的物质一定是离子化合物,只含共价键的物质一定是共价化合物 |
| A. | 3mo/L | B. | 1.5mo/L | C. | 2mo/L | D. | 4mo/L |
| A. | 100mL0.10mol•L-1FeCl3溶液中,Fe3+的离子数目为0.01NA | |
| B. | 0.1mol•L-1的NaHSO4溶液中含有SO42-的总数为0.1NA | |
| C. | 7.8gNa2S固体和7.8gNa2O2固体中含有的阴离子数目均为0.1NA | |
| D. | 标准状态下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA |
| A | B | C | D |
 | 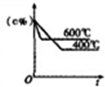 | 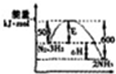 | 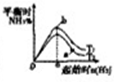 |
| P代表的是压强 | c%是氨气百分含量 | 1molN2和3molH2反应达平衡放出热量92kJ | 平衡常数:Kb>Ka |
| A. | A | B. | B | C. | C | D. | D |
| A. | 原子最外层电子数:Z>X>Y | B. | 单质沸点:X>Y>Z | ||
| C. | 离子半径:X2->Z->Y+ | D. | 原子序数:X>Z>Y |

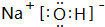
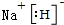 ,QX与X2Z反应生成X单质的化学方程式为NaH+H2O=NaOH+H2↑.
,QX与X2Z反应生成X单质的化学方程式为NaH+H2O=NaOH+H2↑.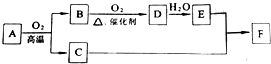 物质A~F有如图所示转化关系(部分生成物未列出),其中A为某金属矿物的主要成分,C是铁红的主要成分.E的浓溶液能与铜发生并有B生成.
物质A~F有如图所示转化关系(部分生成物未列出),其中A为某金属矿物的主要成分,C是铁红的主要成分.E的浓溶液能与铜发生并有B生成.