题目内容
8.设NA为阿伏伽德罗常数的值,下列说法中正确的是( )| A. | 100mL0.10mol•L-1FeCl3溶液中,Fe3+的离子数目为0.01NA | |
| B. | 0.1mol•L-1的NaHSO4溶液中含有SO42-的总数为0.1NA | |
| C. | 7.8gNa2S固体和7.8gNa2O2固体中含有的阴离子数目均为0.1NA | |
| D. | 标准状态下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA |
分析 A.三价铁离子为弱碱阳离子,溶液中存在水解;
B.溶液的体积未知;
C.过氧化钠中的阴离子为过氧根离子,硫化钠和过氧化钠的摩尔质量都是78g/mol;
D.氯气与氢氧化钠溶液飞反应中,氯气既是氧化剂也是还原剂,属于歧化反应.
解答 解:A.三价铁离子在溶液中存在水解,所以100mL0.10mol•L-1FeCl3溶液中,Fe3+的离子数目小于0.01NA,故A错误;
B.溶液的体积未知,无法计算硫酸根离子的物质的量和个数,故B错误;
C.7.8g Na2S和Na2O2的物质的量为:$\frac{7.8g}{78g/mol}$=0.1mol,过氧化钠中阳离子为过氧根离子,则0.1mol混合物中含有0.1mol阴离子,含有的阴离子数等于0.1NA,故C正确;
D.标况下2.24L氯气的物质的量为0.1mol,氯气与氢氧化钠的反应是歧化反应,因此0.1mol氯气与氢氧化钠溶液反应转移了0.1mol电子,转移的电子总数为0.1NA,故D错误;
故选:C.
点评 本题考查阿伏加德罗常数的有关计算和判断,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系是解题关键,注意盐类的水解规律,题目难度不大.

练习册系列答案
相关题目
11.某离子的原子核里有n个质子,该离子的电子层排布与氩原子相同,它所带的电荷可能是( )
| A. | +(n-18) | B. | -n | C. | -(n+18) | D. | +(18-n) |
16.下列离子方程式正确的是( )
| A. | FeBr2溶液中通入少量的Cl2:Cl2+2Fe2+═2Fe3++2Cl- | |
| B. | 大理石溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 向NaHSO4溶液中滴加Ba(OH)2至刚好沉淀完全:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| D. | NaOH溶液中通入过量SO2气体:SO2+2OH-═SO32-+H2O |
13.下列说法中正确的是( )
| A. | 组成上相差一个或若干个CH2原子团,且符合同一通式的有机物互称为同系物 | |
| B. | 苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键 | |
| C. | 蛋白质和油脂都属于高分子化合物,一定条件下均能水解 | |
| D. | 丙烷分子中所有原子不在同一平面上,但3个碳原子在同一直线上 |
20.一定温度下,向2.0L恒容器中充入2molSO2和1molO2,发生反应:2SO2(g)+O2(g)?2SO3(g).经过一段时间后达到平衡,反应过程中测定的部分数据见下表,下列说法正确的是( )
| t/s | 0 | t1 | t2 | t3 | t4 |
| n(SO3)/mol | 0 | 0.6 | 1.2 | 1.8 | 1.8 |
| A. | 反应在前t1s的平均速率v(O2)=0.3/t1 mol•L-1•s-1 | |
| B. | 该温度下反应平衡常数为1.62×10-3L/mol | |
| C. | 相同温度下,起始时向容器中充入4 mol SO3,达到平衡时,SO3的转化率大于10% | |
| D. | 温度不变,向该容器中再充入0.2molSO2、0.1 molO2,1.8molSO3,达到新平衡时SO3转化率升高 |
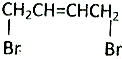 可经四步反应制取HOOCCH=CHCOOH.
可经四步反应制取HOOCCH=CHCOOH.