题目内容
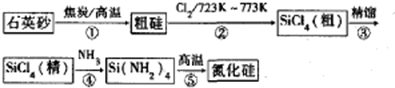
15.随原子序数的递增,七种短周期元素(用字母表示)原子半径的相对大小,最高正价或最低负价的变化如下图所示.
请回答下列问题:
(1)G在元素周期表的位置是第三周期VIIA族;
(2)D,E,F的简单离子半径由大到小的顺序为S2->Na+>Al3+(用离子符号表示)
(3)A,C,D三种元素可组成一种既含离子键又含极性共价键的化合物,其电子式为
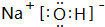
(4)由图中两种元素的原子按1:1组成的液态化合物的稀溶液易被催化分解,可使用的催化剂为ad(填序号).
a.MnO2 b.KMnO4 c.Na2SO3 d.FeCl3
(5)A,B两种元素可形成多种化合物,其中化合物M的化学组成可表示为B5A12,则化合物M的同分异构体有3种,其中某同分异构体的一氯代物只有1种,该同分异构体的结构简式为(CH3)4C.
(6)下列能证明元素D,E金属性强弱的实验或事实的是bc(填序号)
a.比较等物质的量的两种元素的单质分别与足量氧气反应失去电子的多少
b.比较两种元素的最高价氧化物对应水化物的碱性强弱
c.比较两种元素的单质分别与水反应的剧烈程度
请从原子结构的角度解释D,E金属性强弱的原因Na、Al为同周期元素,随原子序数递增,原子半径减小,失去电子能力减弱,金属性减弱.
分析 从图中的化合价和原子半径的大小,可知A是H元素,B是C元素,C是O元素,D是Na,E是Al,F是S元素,G是Cl元素.
(1)主族元素周期数=电子层数,主族族序数=最外层电子数;
(2)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多,离子半径越大;
(3)H、O、Na三种元素可组成一种既含离子键又含极性共价键的化合物为NaOH;
(4)两种元素的原子按1:1组成的常见液态化合物为H2O2,在MnO2或FeCl3催化作用下分解,而Na2SO3具有还原性,与H2O2发生氧化还原反应,高锰酸钾具有强氧化性,与H2O2发生氧化还原反应;
(5)化合物M为C5H12,有正戊烷、异戊烷、新戊烷3种同分异构体,其中新戊烷的一氯代物只有1种;
(6)比较元素的金属性,可通过①最高价氧化物的水化物的碱性强弱;②与水或酸反应的剧烈程度;③金属之间的置换反应;④构成原电池的正负极等角度比较.
解答 解:从图中的化合价和原子半径的大小,可知A是H元素,B是C元素,C是O元素,D是Na,E是Al,F是S元素,G是Cl元素.
(1)G是Cl元素,原子核外有3个电子层,最外层电子数为7,处于周期表中第三周期VIIA族,
故答案为:第三周期VIIA族;
(2)电子层结构相同的离子,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:S2->Na+>Al3+,故答案为:S2->Na+>Al3+;
(3)H、O、Na三种元素可组成一种既含离子键又含极性共价键的化合物为NaOH,电子式为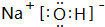 ,故答案为:
,故答案为: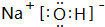 ;
;
(4)两种元素的原子按1:1组成的常见液态化合物为H2O2,在MnO2或FeCl3催化作用下分解,而Na2SO3具有还原性,与H2O2发生氧化还原反应,不能用作催化剂,高锰酸钾具有强氧化性,与H2O2发生氧化还原反应,也不能作催化剂,故答案为:ad;
(5)化合物M为C5H12,有正戊烷、异戊烷、新戊烷3种同分异构体,其中(CH3)4C的一氯代物只有1种,
故答案为:3;(CH3)4C;
(6)a.金属性的强弱与失去电子的难易有关,与失去电子的多少无关,故a错误;
b.金属性越强,最高价氧化物对应水化物的碱性越强,故b正确;
c.金属单质与水反应越剧烈,该金属的金属性越强,故c正确;
Na、Al为同周期元素,随原子序数递增,原子半径减小,失去电子能力减弱,金属性减弱,
故答案为:bc;Na、Al为同周期元素,随原子序数递增,原子半径减小,失去电子能力减弱,金属性减弱.
点评 本题考查结构位置性质关系综合应用,关键是根据化合价与原子半径推断元素,注意金属性、非金属性强弱比较实验事实.

| A. | K2O2既是氧化剂又是还原剂 | |
| B. | K2FeO4的氧化性强于K2O2 | |
| C. | 16gFe2O3发生反应,有0.3mole-转移 | |
| D. | 用K2FeO4处理水时有Fe(OH)3胶体生成 |
| t/s | 0 | t1 | t2 | t3 | t4 |
| n(SO3)/mol | 0 | 0.6 | 1.2 | 1.8 | 1.8 |
| A. | 反应在前t1s的平均速率v(O2)=0.3/t1 mol•L-1•s-1 | |
| B. | 该温度下反应平衡常数为1.62×10-3L/mol | |
| C. | 相同温度下,起始时向容器中充入4 mol SO3,达到平衡时,SO3的转化率大于10% | |
| D. | 温度不变,向该容器中再充入0.2molSO2、0.1 molO2,1.8molSO3,达到新平衡时SO3转化率升高 |
| A. | 有大量的氯气泄漏时,用肥皂水浸湿软布蒙面,并迅速离开现场 | |
| B. | 金属钠着火燃烧时,用泡沫灭火器灭火 | |
| C. | NaCl必须保存在棕色瓶中 | |
| D. | 含硫酸的废液倒入水槽,用水冲入下水道 |
| A. | Na2CO3 | B. | Na2S | C. | FeCl3 | D. | NaCl |