题目内容
12.工业合成氨是人类科学技术上的一个重大突破,其反应过程为N2+3H2$?_{催化剂}^{高温高压}$2NH3;△H<0.若反应在恒容的容器中进行,下列由该反应的相关图象做出判断正确的是( )| A | B | C | D |
 |  |  |  |
| P代表的是压强 | c%是氨气百分含量 | 1molN2和3molH2反应达平衡放出热量92kJ | 平衡常数:Kb>Ka |
| A. | A | B. | B | C. | C | D. | D |
分析 A.合成氨增大压强平衡向正反应方向移动;
B.根据合成氨反应为放热反应,温度高平衡向逆反应方向移动;
C.根据合成氨为可逆反应,不可能反应到底分析;
D.温度高平衡向逆反应方向移动,所以温度越低平衡时氨气的量越多,平衡常数越大.
解答 解:A.合成氨增大压强平衡向正反应方向移动,所以平衡后正反应速率应大于逆反应速率,故A错误;
B.合成氨反应为放热反应,温度高平衡向逆反应方向移动,所以温度越高氨气百分含量越低,故B错误;
C.由图象可知 1molN2和3molH2完全反应放出热量92kJ,又合成氨为可逆反应,不可能反应到底,所以放出热量小于92kJ,故C错误;
D.因为温度高平衡向逆反应方向移动,所以温度越低平衡时氨气的量越多,平衡常数越大,所以平衡常数:Kb>Ka,故D正确;
故选D.
点评 本题以图象形式,考查化学反应中能量变化、化学平衡图象及影响因素等,难度中等.

练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目
20.一定温度下,向2.0L恒容器中充入2molSO2和1molO2,发生反应:2SO2(g)+O2(g)?2SO3(g).经过一段时间后达到平衡,反应过程中测定的部分数据见下表,下列说法正确的是( )
| t/s | 0 | t1 | t2 | t3 | t4 |
| n(SO3)/mol | 0 | 0.6 | 1.2 | 1.8 | 1.8 |
| A. | 反应在前t1s的平均速率v(O2)=0.3/t1 mol•L-1•s-1 | |
| B. | 该温度下反应平衡常数为1.62×10-3L/mol | |
| C. | 相同温度下,起始时向容器中充入4 mol SO3,达到平衡时,SO3的转化率大于10% | |
| D. | 温度不变,向该容器中再充入0.2molSO2、0.1 molO2,1.8molSO3,达到新平衡时SO3转化率升高 |
7.在实验室中,对下列事故或药品的处理正确的是( )
| A. | 有大量的氯气泄漏时,用肥皂水浸湿软布蒙面,并迅速离开现场 | |
| B. | 金属钠着火燃烧时,用泡沫灭火器灭火 | |
| C. | NaCl必须保存在棕色瓶中 | |
| D. | 含硫酸的废液倒入水槽,用水冲入下水道 |
4.常温下,下列盐的水溶液pH<7的是( )
| A. | Na2CO3 | B. | Na2S | C. | FeCl3 | D. | NaCl |
1.下列反应的离子方程式正确的是( )
| A. | 稀硫酸与氢氧化钡溶液混合:SO42-+Ba2+═BaSO4↓ | |
| B. | 钠与硫酸铜溶液反应:2Na+2Cu2+═2Na++Cu | |
| C. | Cl2通入NaOH溶液:Cl2+2OH-═Cl-+CLO-+H2O | |
| D. | 氧化铜溶于硫酸:O2-+2H+═H2O |
2.下列物质的主要成分,不属于有机物的是( )
| A. | 光导纤维 | B. | 脱脂棉 | C. | 维生素 | D. | 液化石油气 |
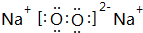 .
. 可经四步反应制取HOOCCH=CHCOOH.
可经四步反应制取HOOCCH=CHCOOH.