题目内容
10. 物质A~F有如图所示转化关系(部分生成物未列出),其中A为某金属矿物的主要成分,C是铁红的主要成分.E的浓溶液能与铜发生并有B生成.
物质A~F有如图所示转化关系(部分生成物未列出),其中A为某金属矿物的主要成分,C是铁红的主要成分.E的浓溶液能与铜发生并有B生成.(1)形成下列物质的化学式:BSO2,CFe2O3;
(2)B→D转化的化学方程式为2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3;
(3)E的浓溶液与铜反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(4)验证F溶液中所含金属阳离子的试剂为KSCN溶液;
(5)请举出一个F表现氧化性的反应实例:2Fe3++Cu=2Fe2++Cu2+(用离子方程式表示).
分析 A为某金属矿物的主要成分,与氧气反应得到C与B,C是铁红的主要成分,则C为Fe2O3,B氧化得到D,D与水反应得到E,E的浓溶液能与铜发生并有B生成,则A为FeS2、B为SO2、D为SO3、E为H2SO4,F为Fe2(SO4)3,据此解答.
解答 解:A为某金属矿物的主要成分,与氧气反应得到C与B,C是铁红的主要成分,则C为Fe2O3,B氧化得到D,D与水反应得到E,E的浓溶液能与铜发生并有B生成,则A为FeS2、B为SO2、D为SO3、E为H2SO4,F为Fe2(SO4)3.
(1)由上述分析可知,B为SO2,C为Fe2O3,故答案为:SO2;Fe2O3;
(2)B→D转化的化学方程式为:2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3,故答案为:2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3;
(3)E的浓溶液与铜反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(4)验证Fe2(SO4)3溶液中所含金属阳离子的试剂为:KSCN溶液,故答案为:KSCN溶液;
(5)F表现氧化性的反应实例:2Fe3++Cu=2Fe2++Cu2+,故答案为:2Fe3++Cu=2Fe2++Cu2+.
点评 本题考查无机物推断,“C是铁红的主要成分,E的浓溶液能与铜发生并有B生成”是推断突破口,需要学生熟练掌握元素化合物知识及中学常见化学工业.

练习册系列答案
相关题目
20.一定温度下,向2.0L恒容器中充入2molSO2和1molO2,发生反应:2SO2(g)+O2(g)?2SO3(g).经过一段时间后达到平衡,反应过程中测定的部分数据见下表,下列说法正确的是( )
| t/s | 0 | t1 | t2 | t3 | t4 |
| n(SO3)/mol | 0 | 0.6 | 1.2 | 1.8 | 1.8 |
| A. | 反应在前t1s的平均速率v(O2)=0.3/t1 mol•L-1•s-1 | |
| B. | 该温度下反应平衡常数为1.62×10-3L/mol | |
| C. | 相同温度下,起始时向容器中充入4 mol SO3,达到平衡时,SO3的转化率大于10% | |
| D. | 温度不变,向该容器中再充入0.2molSO2、0.1 molO2,1.8molSO3,达到新平衡时SO3转化率升高 |
1.下列反应的离子方程式正确的是( )
| A. | 稀硫酸与氢氧化钡溶液混合:SO42-+Ba2+═BaSO4↓ | |
| B. | 钠与硫酸铜溶液反应:2Na+2Cu2+═2Na++Cu | |
| C. | Cl2通入NaOH溶液:Cl2+2OH-═Cl-+CLO-+H2O | |
| D. | 氧化铜溶于硫酸:O2-+2H+═H2O |
15.化学在生成和日常生活中有着重要的应用.下列说法不正确的是( )
| A. | 明矾水解成Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 | |
| B. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| C. | 通过地沟油(油脂)的碱性水解来制肥皂 | |
| D. | 电解MgCl2饱和溶液,可制得金属镁 |
2.下列物质的主要成分,不属于有机物的是( )
| A. | 光导纤维 | B. | 脱脂棉 | C. | 维生素 | D. | 液化石油气 |
19.下列反应中,属于氧化还原反应且反应前后能量变化如图所示的是( )


| A. | 氢氧化钾与硫酸的反应 | |
| B. | 高温条件下铝与氧化铁的反应 | |
| C. | 高温条件下碳粉与二氧化碳的反应 | |
| D. | Ba(0H)2•8H20晶体与NH4C1固体的反应 |
11.下列有关化学用语的表示正确的是( )
| A. | 过氧化氢的电子式为  | B. | 1,3-二甲基丁烷 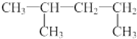 | ||
| C. | Na+的结构示意图为  | D. | 乙烯的结构式为  |
