题目内容
9.X、Y、Z均为短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-具有相同的电子层结构,下列说法一定正确的是( )| A. | 原子最外层电子数:Z>X>Y | B. | 单质沸点:X>Y>Z | ||
| C. | 离子半径:X2->Z->Y+ | D. | 原子序数:X>Z>Y |
分析 X、Z的最低价离子分别为X2-和Z-,则X为第ⅥA族元素,Z为ⅦA族元素;Y+和Z-具有相同的电子层结构,则Y在Z的下一周期,则Y为Na元素,Z为F元素,X、Y同周期,则X为S元素,结合元素在周期表中的位置以及元素周期律知识解答该题.
解答 解:X、Z的最低价离子分别为X2-和Z-,则X为第ⅥA族元素,Z为ⅦA族元素;Y+和Z-具有相同的电子层结构,则Y在Z的下一周期,则Y为Na元素,Z为F元素,X、Y同周期,则X为S元素.
A.X、Y、Z分别为S、Na、F,原子最外层电子数分别为6、1、7,原子最外层电子数:Z>X>Y,故A正确;
B.Na、S为固体,氟气常温下为气体,故氟气的沸点最低,Na的熔点较低,但钠的沸点高于硫,故沸点:Na>S>F2,故B错误;
C.Na+、F-具有相同的核外电子排布,离子的核电荷数越大,半径越小,应为F->Na+,S2-电子层最多,离子半径最大,故离子半径S2->F->Na+,故C正确;
D.X、Y、Z原子序数分别为16、11、9,原子序数:X>Y>Z,故D错误.
故选AC.
点评 本题考查原子结构与元素周期律的关系,侧重于学生的分析能力的考查,题目难度不大,本题的关键是根据原子结构特点正确推断元素的种类.

练习册系列答案
相关题目
11.某离子的原子核里有n个质子,该离子的电子层排布与氩原子相同,它所带的电荷可能是( )
| A. | +(n-18) | B. | -n | C. | -(n+18) | D. | +(18-n) |
20.一定温度下,向2.0L恒容器中充入2molSO2和1molO2,发生反应:2SO2(g)+O2(g)?2SO3(g).经过一段时间后达到平衡,反应过程中测定的部分数据见下表,下列说法正确的是( )
| t/s | 0 | t1 | t2 | t3 | t4 |
| n(SO3)/mol | 0 | 0.6 | 1.2 | 1.8 | 1.8 |
| A. | 反应在前t1s的平均速率v(O2)=0.3/t1 mol•L-1•s-1 | |
| B. | 该温度下反应平衡常数为1.62×10-3L/mol | |
| C. | 相同温度下,起始时向容器中充入4 mol SO3,达到平衡时,SO3的转化率大于10% | |
| D. | 温度不变,向该容器中再充入0.2molSO2、0.1 molO2,1.8molSO3,达到新平衡时SO3转化率升高 |
4.常温下,下列盐的水溶液pH<7的是( )
| A. | Na2CO3 | B. | Na2S | C. | FeCl3 | D. | NaCl |
14.下列关于无机非金属材料的说法错误的是( )
| A. | 玻璃、水泥、陶瓷均属于无机非金属材料 | |
| B. | 玻璃、水泥、陶瓷都可由纯碱、石灰石与石英制得 | |
| C. | 高纯度的二氧化硅广泛用于制作光导纤维 | |
| D. | 半导体材料晶体硅可用二氧化硅来制取 |
1.下列反应的离子方程式正确的是( )
| A. | 稀硫酸与氢氧化钡溶液混合:SO42-+Ba2+═BaSO4↓ | |
| B. | 钠与硫酸铜溶液反应:2Na+2Cu2+═2Na++Cu | |
| C. | Cl2通入NaOH溶液:Cl2+2OH-═Cl-+CLO-+H2O | |
| D. | 氧化铜溶于硫酸:O2-+2H+═H2O |
19.下列反应中,属于氧化还原反应且反应前后能量变化如图所示的是( )


| A. | 氢氧化钾与硫酸的反应 | |
| B. | 高温条件下铝与氧化铁的反应 | |
| C. | 高温条件下碳粉与二氧化碳的反应 | |
| D. | Ba(0H)2•8H20晶体与NH4C1固体的反应 |
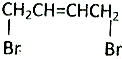 可经四步反应制取HOOCCH=CHCOOH.
可经四步反应制取HOOCCH=CHCOOH.