题目内容
3. 氨水是一种的常用的化学试剂.
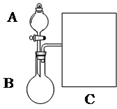
氨水是一种的常用的化学试剂.(1)以浓氨水和生石灰为原料,用如下装置为发生装置,可制取少量氨 气.已知:NH3•H2O+CaO═Ca(OH)2+NH3↑.
①生石灰应该装在B(填A或B).
②试从电离平衡角度分析该实验中氨气逸出的原因:CaO与水反应生成Ca(OH)2,溶液中OH-浓度增大,使NH3+H2O?NH4++OH-平衡逆向移动,有利于NH3逸出
③现要用试管和必要实验用品收集一试管氨气,请在C处补充相应收集装置.
(2)化学兴趣小组用氨水与硝酸银溶液配制好银氨溶液后,进行乙醛的银镜反应实验,但部分同学实验时间长,且效果不明显.影响乙醛银镜反应速率的因素有哪些呢?请你完成如下猜想:
①猜想:因素一:银氨溶液的pH大小;
因素二:水浴加热的条件.
②你设计实验验证上述“因素一”,完成下表中内容.
提供试剂:乙醛、2%稀氨水、0.25mol/L NaOH溶液、盐酸、2% AgNO3溶液
实验用品:烧杯(装有热水)、试管
| 实验步骤 | 实验操作 | 预期现象及结论 (步骤1只写现象) |
| 1 | 在A、B两支洁净的试管中各加入1mL 2%的AgNO3溶液,然后边振荡试管边逐滴滴入2%稀氨水,至沉淀恰好溶解,此时制得pH均约为8的银氨溶液. | 先生成白色沉淀 后沉淀溶解 |
| 2 | 往A、B试管加入3滴乙醛,然后在A试管中加1滴NaOH溶液;振荡后将两支试管放在热水浴中温热. | 若A试管比B试管出现的银镜时间短、光亮,则则溶液pH大 反应速率快; 若A试管比B试管出现的银镜时间长,则则溶液pH大 反应速率慢. |
分析 (1)①依据物质的状态确定存放的位置;
②生石灰与水反应生成碱,结合一水合氨电离平衡移动的影响因素分析;
③氨气密度小于空气密度,用向下排气法收集;考虑氨气污染空气,应进行吸收处理;
(2)①银镜反应的关键有两个:1银氨溶液的配置,该反应是在碱性环境下发生;2反应的条件:水浴加热;
②AgNO3溶液与氨水反应生成氢氧化银沉淀,氢氧化银再和氨水发生络合反应生成可溶性络合物;分别做两组银镜反应的实验,一组加少量碱,一组不加在相同的水浴条件下反应根据反应速率快慢解答.
解答 解:(1)①生石灰是固体应盛放在烧瓶中,
故答案为:B;
②一水合氨存在电离平衡NH3+H2O?NH4++OH-,生石灰与水反应生成碱使溶液中的氢氧根离子浓度增大,根据平衡移动的规律,增大氢氧根离子浓度,平衡向逆方向进行,有利于氨气的逸出,
故答案为:CaO与水反应生成Ca(OH)2,溶液中OH-浓度增大,使NH3+H2O?NH4++OH-平衡逆向移动,有利于NH3逸出;
③氨气密度小于空气密度,用向下排气法收集;考虑氨气污染空气,可用蘸有硫酸的棉花团进行吸收处理,
故答案为: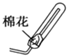 ;
;
(2)①银镜反应的关键有两个:1银氨溶液的配置,该反应是在碱性环境下发生;2反应的条件:水浴加热.猜想:因素一:银氨溶液的pH大小,所以因素二:水浴加热的条件,
故答案为:水浴加热的条件;
②AgNO3溶液与氨水反应生成氢氧化银沉淀,氢氧化银再和氨水发生络合反应生成可溶性络合物,预期看到的现象为:先产生白色沉淀,然后沉淀逐渐溶解,
要验证因素一:银氨溶液的pH大小对反应的影响,应该定住因素二,也就是在相同的热水浴中做PH值不同条件下的两组银镜反应,通过反应速率快慢验证结论,
即往A、B试管加入几滴乙醛,然后在A试管中加多1滴NaOH溶液;振荡后将两支试管放在相同的热水浴中温热,若A试管比B试管出现的银镜时间短、光亮,则溶液pH大,反应速率快;若A试管比B试管出现的银镜时间长,则溶液pH大,反应速率慢,
故答案为:
| 实验步骤 | 实验操作 | 预期现象及结论(步骤1只填现象) |
| 1 | 边振荡试管边逐滴滴入2%稀氨水,至沉淀恰好溶解 | 先生成白色沉淀,后沉淀溶解 |
| 2 | 1滴NaOH溶液 | 则溶液pH大,反应速率快; 则溶液pH大,反应速率慢. |
点评 本题考查了氨气的简易制备和性质,银镜反应的实验,酸碱滴定测碱的物质的量浓度,题目综合性强,难度中等,注意银镜反应中银氨溶液的配置和银镜反应的条件.

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案 利用如图所示装置(省略加热和夹持装置)进行下列实验,不能得出相应实验结论的是( )
利用如图所示装置(省略加热和夹持装置)进行下列实验,不能得出相应实验结论的是( )| 选项 | ① | ② | ③ | 实验结论 |
| A | 浓氨水 | CaO | 滴有酚酞的水 | 氨气显碱性 |
| B | 浓盐酸 | MnO2 | 淀粉碘化钾溶液 | 氧化性:Cl2>I2 |
| C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | SO2与可溶性钡盐均能反应生成白色沉淀 |
| D | 硫酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:硫>碳>硅 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 氯化钠属于离子化合物,只存在Na+、Cl-的离子形式,不存在NaCl分子 | |
| B. | 化学冰袋(硝酸铵、碳酸钠晶体)冷藏食物利用了其反应和溶解吸热的原理 | |
| C. | 血液透析技术利用了胶体与有害物质微粒直径不同的特点 | |
| D. | 酒精检测仪检测司机是否酒后驾车利用了乙醇的还原性 |
| A. | 液氨汽化吸热,故液氨常做食品工厂的制冷剂 | |
| B. | 硅酸钠的水溶液俗称水玻璃,可用作木材防腐剂和阻燃剂 | |
| C. | 水晶项链和餐桌上的瓷盘都是硅酸盐制品 | |
| D. | 可用冷的浓硝酸迅速除去铝壶底的水垢 |
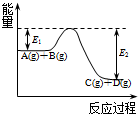
| A. | 在不同温度下,以相同浓度相同体积的Na2S2O3与H2SO4反应来探究温度对化学反应速率的影响: 3S2O32-+2SO42-+10 H+═6SO2↑+2S↓+5 H2O | |
| B. | 已知25℃、101 kPa时,1 mol H2与溴蒸气完全反应生成气态HBr放出能量Q kJ,其热化学方程式为H2(g)+Br2(g)═2HBr(g)△H=-2Q kJ•mol-1 | |
| C. | 表示中和热的热化学方程式:2HCl(aq)+Ba(OH)2(aq)═BaCl2(aq)+2H2O(l)△H=-114.6 kJ•mol-1 | |
| D. | 酸性条件下,KI被O2氧化的离子方程式:4I-+O2+4H+=2I2+2H2O |
 (1)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6).丙烷脱氢可得丙烯.
(1)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6).丙烷脱氢可得丙烯. ,F水溶液显性碱性(填:酸性、中性或碱性).
,F水溶液显性碱性(填:酸性、中性或碱性).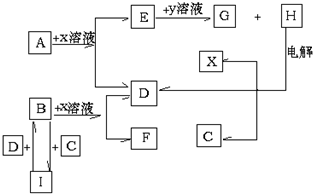
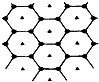 碳的一种单质石墨呈层状结构,有一碳镁新型材料就是在石墨碳原子层间加入镁原子层,两层俯视图:该材料的化学式为MgC2.
碳的一种单质石墨呈层状结构,有一碳镁新型材料就是在石墨碳原子层间加入镁原子层,两层俯视图:该材料的化学式为MgC2.