题目内容
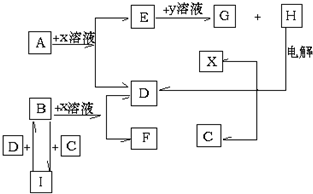
15.A、B、C、D是短周期元素所形成的单质,也是中学化学中常见的物质,通常情况下,A、B为固体,C、D为气体,电解H的水溶液生成X、C和D,此反应是一个重要的化工反应,这些物质间相互转化关系如下图所示.试回答:(1)H的化学式为NaCl;
(2)B单质为原子晶体(填晶体类型).
(3)X的电子式为
 ,F水溶液显性碱性(填:酸性、中性或碱性).
,F水溶液显性碱性(填:酸性、中性或碱性).(4)E和G化合物的水溶液混合发生反应,其离子方程式为:3AlO2-+Al3++6H2O═4Al(OH)3↓
(5)用惰性电极电解含0.2molH物质的水溶液,在阳极产生0.2mol气体时,此时溶液的体积为200ml.则溶液的pH=14.
分析 电解H的水溶液生成X、C和D,此反应是一个重要的化工反应,可联想到氯碱工业,H应为NaCl,则X为NaOH,C、D都为气体,由转化关系可知C为Cl2,D为H2,A、B都可与氢氧化钠溶液反应生成氢气,则应分别为Al、Si,由B和I的转化可知B应为Si,I为SiCl4,F为Na2SiO3,则A为Al,E为NaAlO2,Y为HCl,G为AlCl3,结合对应物质的性质以及题目要求解答该题.
解答 解:电解H的水溶液生成X、C和D,此反应是一个重要的化工反应,可联想到氯碱工业,H应为NaCl,则X为NaOH,C、D都为气体,由转化关系可知C为Cl2,D为H2,A、B都可与氢氧化钠溶液反应生成氢气,则应分别为Al、Si,由B和I的转化可知B应为Si,I为SiCl4,F为Na2SiO3,则A为Al,E为NaAlO2,Y为HCl,G为AlCl3,
(1)由以上分析可知H为NaCl,故答案为:NaCl;
(2)B应为Si,单质为原子晶体,故答案为:原子;
(3)X为NaOH,为离子化合物,电子式为 ,F为Na2SiO3,为强碱弱酸盐,溶液呈碱性,故答案为:
,F为Na2SiO3,为强碱弱酸盐,溶液呈碱性,故答案为: ;碱性;
;碱性;
(4)E为NaAlO2,G为AlCl3,二者发生互促水解反应,离子方程式为3AlO2-+Al3++6H2O═4Al(OH)3↓,故答案为:3AlO2-+Al3++6H2O═4Al(OH)3↓;
(5)用惰性电极电解含0.2molNaCl物质的水溶液,在阳极产生0.2mol气体时,由2NaCl+2H2O $\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2NaOH,可知生成0.2molNaOH,此时溶液的体积为200mL.则溶液的pH=14,
故答案为:14.
点评 本题考查无机物的推断,侧重于学生的分析能力和计算能力的考查,为高考常见题型,注意元素化合物知识的积累,把握常见物质的性质,难度中等.

| A. | 加热分解NaHCO3 | B. | 加热硫酸铜晶体 | C. | 熔化烧碱 | D. | 加热氯酸钾 |
 氨水是一种的常用的化学试剂.
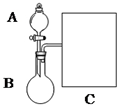
氨水是一种的常用的化学试剂.(1)以浓氨水和生石灰为原料,用如下装置为发生装置,可制取少量氨 气.已知:NH3•H2O+CaO═Ca(OH)2+NH3↑.
①生石灰应该装在B(填A或B).
②试从电离平衡角度分析该实验中氨气逸出的原因:CaO与水反应生成Ca(OH)2,溶液中OH-浓度增大,使NH3+H2O?NH4++OH-平衡逆向移动,有利于NH3逸出
③现要用试管和必要实验用品收集一试管氨气,请在C处补充相应收集装置.
(2)化学兴趣小组用氨水与硝酸银溶液配制好银氨溶液后,进行乙醛的银镜反应实验,但部分同学实验时间长,且效果不明显.影响乙醛银镜反应速率的因素有哪些呢?请你完成如下猜想:
①猜想:因素一:银氨溶液的pH大小;
因素二:水浴加热的条件.
②你设计实验验证上述“因素一”,完成下表中内容.
提供试剂:乙醛、2%稀氨水、0.25mol/L NaOH溶液、盐酸、2% AgNO3溶液
实验用品:烧杯(装有热水)、试管
| 实验步骤 | 实验操作 | 预期现象及结论 (步骤1只写现象) |
| 1 | 在A、B两支洁净的试管中各加入1mL 2%的AgNO3溶液,然后边振荡试管边逐滴滴入2%稀氨水,至沉淀恰好溶解,此时制得pH均约为8的银氨溶液. | 先生成白色沉淀 后沉淀溶解 |
| 2 | 往A、B试管加入3滴乙醛,然后在A试管中加1滴NaOH溶液;振荡后将两支试管放在热水浴中温热. | 若A试管比B试管出现的银镜时间短、光亮,则则溶液pH大 反应速率快; 若A试管比B试管出现的银镜时间长,则则溶液pH大 反应速率慢. |
| A. | C60气化和I2升华克服的作用力相同 | |
| B. | 甲酸甲酯和乙酸的分子式相同,它们的熔点相近 | |
| C. | 氯化钠和氯化氢溶于水时,破坏的化学键都是离子键 | |
| D. | 用作高温结构陶瓷材料的固体是分子晶体 |
| A. | 25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA | |
| B. | 1mol CH3+(碳正离子)中含有电子数为10NA | |
| C. | 室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA | |
| D. | 1mol乙烷分子含有8NA个共价键 |
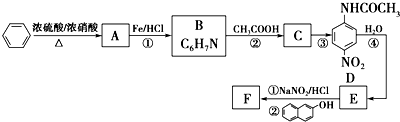
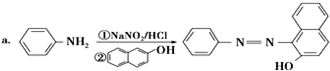
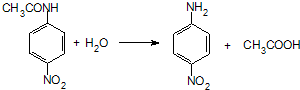 .
.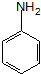 ;设计反应②和④的目的是保护氨基不被氧化.
;设计反应②和④的目的是保护氨基不被氧化.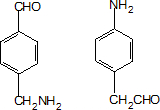 .
. 3,3,5,5-四甲基庚烷;
3,3,5,5-四甲基庚烷;