题目内容
18.下列离子方程式或热化学方程式正确的是( )| A. | 在不同温度下,以相同浓度相同体积的Na2S2O3与H2SO4反应来探究温度对化学反应速率的影响: 3S2O32-+2SO42-+10 H+═6SO2↑+2S↓+5 H2O | |
| B. | 已知25℃、101 kPa时,1 mol H2与溴蒸气完全反应生成气态HBr放出能量Q kJ,其热化学方程式为H2(g)+Br2(g)═2HBr(g)△H=-2Q kJ•mol-1 | |
| C. | 表示中和热的热化学方程式:2HCl(aq)+Ba(OH)2(aq)═BaCl2(aq)+2H2O(l)△H=-114.6 kJ•mol-1 | |
| D. | 酸性条件下,KI被O2氧化的离子方程式:4I-+O2+4H+=2I2+2H2O |
分析 A、Na2S2O3与H2SO4反应中,发生自身氧化还原;
B、根据氢气与放出的热量的关系可计算出反应热,并作判断;
C、中和热是指生成1mol水的反应热;
D、根据电荷守恒和元素守恒判断.
解答 解:A、Na2S2O3与H2SO4反应中,发生自身氧化还原,所以在离子反应中,SO42-没有参加反应,故A错误;
B、1 mol H2与溴蒸气完全反应生成气态HBr放出能量Q kJ,其热化学方程式为H2(g)+Br2(g)═2HBr(g)△H=-Q kJ•mol-1,故B错误;
C、中和热是指1mol氢离子和1mol氢氧根离子反应生成1mol水的反应热,故C错误;
D、根据电荷守恒和元素守恒可知,酸性条件下,KI被O2氧化的离子方程式:4I-+O2+4H+=2I2+2H2,故D正确,
故选D.
点评 本题主要考查热化学方程式和离子方程式,难度不大,答题时注意氧化还原反应的实质和中和热的定义,这是本题的易错点.

练习册系列答案
相关题目
8.若在铜片上镀银时,下列叙述正确的是( )
①将铜片接在电池的正极上,
②将银片接在电源的正极上,
③在铜片上发生的反应是:Ag++e-═Ag,
④在银片上发生的反应是:4OH--4e-═O2+2H2O,
⑤需用CuSO4溶液,
⑥需用AgNO3溶液作电解液.
①将铜片接在电池的正极上,
②将银片接在电源的正极上,
③在铜片上发生的反应是:Ag++e-═Ag,
④在银片上发生的反应是:4OH--4e-═O2+2H2O,
⑤需用CuSO4溶液,
⑥需用AgNO3溶液作电解液.
| A. | ②③⑥ | B. | ①③⑥ | C. | ①④⑤ | D. | ②③④⑥ |
6.下列操作不能在石英坩埚中进行的是( )
| A. | 加热分解NaHCO3 | B. | 加热硫酸铜晶体 | C. | 熔化烧碱 | D. | 加热氯酸钾 |
13.自来水可用氯气消毒,某学生用这种自来水去配制下列物质溶液,不会产生明显的药品变质问题的是( )
| A. | NaNO3 | B. | FeCl2 | C. | Na2SO3 | D. | NaOH |
3.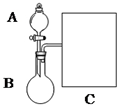 氨水是一种的常用的化学试剂.
氨水是一种的常用的化学试剂.
(1)以浓氨水和生石灰为原料,用如下装置为发生装置,可制取少量氨 气.已知:NH3•H2O+CaO═Ca(OH)2+NH3↑.
①生石灰应该装在B(填A或B).
②试从电离平衡角度分析该实验中氨气逸出的原因:CaO与水反应生成Ca(OH)2,溶液中OH-浓度增大,使NH3+H2O?NH4++OH-平衡逆向移动,有利于NH3逸出
③现要用试管和必要实验用品收集一试管氨气,请在C处补充相应收集装置.
(2)化学兴趣小组用氨水与硝酸银溶液配制好银氨溶液后,进行乙醛的银镜反应实验,但部分同学实验时间长,且效果不明显.影响乙醛银镜反应速率的因素有哪些呢?请你完成如下猜想:
①猜想:因素一:银氨溶液的pH大小;
因素二:水浴加热的条件.
②你设计实验验证上述“因素一”,完成下表中内容.
提供试剂:乙醛、2%稀氨水、0.25mol/L NaOH溶液、盐酸、2% AgNO3溶液
实验用品:烧杯(装有热水)、试管
 氨水是一种的常用的化学试剂.
氨水是一种的常用的化学试剂.(1)以浓氨水和生石灰为原料,用如下装置为发生装置,可制取少量氨 气.已知:NH3•H2O+CaO═Ca(OH)2+NH3↑.
①生石灰应该装在B(填A或B).
②试从电离平衡角度分析该实验中氨气逸出的原因:CaO与水反应生成Ca(OH)2,溶液中OH-浓度增大,使NH3+H2O?NH4++OH-平衡逆向移动,有利于NH3逸出
③现要用试管和必要实验用品收集一试管氨气,请在C处补充相应收集装置.
(2)化学兴趣小组用氨水与硝酸银溶液配制好银氨溶液后,进行乙醛的银镜反应实验,但部分同学实验时间长,且效果不明显.影响乙醛银镜反应速率的因素有哪些呢?请你完成如下猜想:
①猜想:因素一:银氨溶液的pH大小;
因素二:水浴加热的条件.
②你设计实验验证上述“因素一”,完成下表中内容.
提供试剂:乙醛、2%稀氨水、0.25mol/L NaOH溶液、盐酸、2% AgNO3溶液
实验用品:烧杯(装有热水)、试管
| 实验步骤 | 实验操作 | 预期现象及结论 (步骤1只写现象) |
| 1 | 在A、B两支洁净的试管中各加入1mL 2%的AgNO3溶液,然后边振荡试管边逐滴滴入2%稀氨水,至沉淀恰好溶解,此时制得pH均约为8的银氨溶液. | 先生成白色沉淀 后沉淀溶解 |
| 2 | 往A、B试管加入3滴乙醛,然后在A试管中加1滴NaOH溶液;振荡后将两支试管放在热水浴中温热. | 若A试管比B试管出现的银镜时间短、光亮,则则溶液pH大 反应速率快; 若A试管比B试管出现的银镜时间长,则则溶液pH大 反应速率慢. |
10.下列说法中正确的是( )
| A. | C60气化和I2升华克服的作用力相同 | |
| B. | 甲酸甲酯和乙酸的分子式相同,它们的熔点相近 | |
| C. | 氯化钠和氯化氢溶于水时,破坏的化学键都是离子键 | |
| D. | 用作高温结构陶瓷材料的固体是分子晶体 |
 已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态;D原子L电子层上有2对成对电子;E+原子核外有3层电子且各层均处于全满状态.
已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态;D原子L电子层上有2对成对电子;E+原子核外有3层电子且各层均处于全满状态. .
.