题目内容
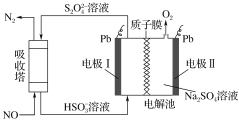
【题目】普通干电池是一种广泛使用的可移动化学电源。 某同学在探究废酸性干电池内物质回收利用时,进行如图所示实验:
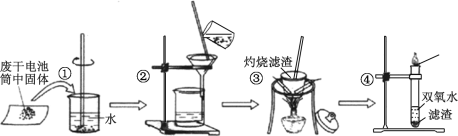
请回答以下问题:
(1)干电池工作时正极电极反应式为:2NH4++2e- = 2NH3↑+H2↑,则负极电极反应式是___________。 电池中加入 MnO2 的作用是除去正极上的某产物, 本身生成Mn2O3,该反应的化学方程式是_______________。
(2)步骤③灼烧滤渣时所用主要仪器有酒精灯、玻璃棒、______ 、泥三角和三脚架;灼烧滤渣时,产生一种无色无味能使澄清石灰水变浑浊的气体,由此推测灼烧前的滤渣中存在的物质有_____。
(3)向步骤④的试管中加入步骤③灼烧后所得黑色固体,试管中迅速产生能使带火星的木条复燃的气体,据此可初步认定灼烧后的黑色固体为_____。
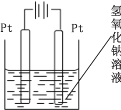
(4)查询资料得知,通过电解可将 Mn2O3 转化为 MnO2。 为此某同学设计了如图所示装置,并将混合物粉末调成糊状,附在其中的_________(填“左”或“右”)边电极上,该电极上发生反应的电极反应式是_____, 在电解过程中溶液的 pH 将__________(填“变大”、“变小”或“不变”)。
【答案】Zn-2e-= Zn2+ 2MnO2+H2=Mn2O3+H2O 坩埚 C(碳) 二氧化锰(MnO2) 左 Mn2O3+2OH--2e-=2MnO2+H2O 变大
【解析】
(1) 在锌锰干电池中,活泼金属锌为电池负极,反应式为Zn-2e-= Zn2+,MnO2生成Mn2O3,该过程中的Mn化合价降低,被还原,还原剂就是正极产物氢气,反应式为2MnO2+H2= Mn2O3+H2O;
(2) 灼烧操作需要坩埚,转移坩埚需要坩埚钳,坩埚需要放置在三脚架或铁架台的铁圈上的泥三角中,灼烧过程中要用玻璃棒搅拌,则还缺少的仪器为坩埚;无色无味能使澄清石灰水变浑浊的气体为二氧化碳,说明分离出的固体残渣中含有碳单质(C);
(3)双氧水在催化剂二氧化锰作用下可快速释放出氧气,氧气能使带火星的木条复燃,则灼烧产生的黑色固体中含有二氧化锰;
(4)以通过电解的方式,将Mn2O3转化为MnO2,在阳极上失去电子实现转化,由图可知,左侧与电源正极相连为阳极,则将混合物粉末调成糊状,附在其中的左边电极上,该电极上发生的电极反应式是:Mn2O3-2e+2OH=2MnO2+H2O,阴极氢离子放电,2H2O+2e=2OH+H2↑,总反应消耗水,最终氢氧根离子浓度增大,则在电解过程中溶液的pH将变大。

 阅读快车系列答案
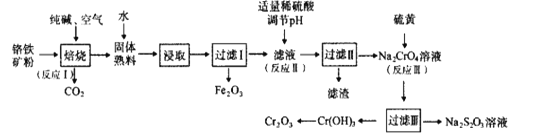
阅读快车系列答案【题目】重铬酸钠晶体 ![]() 俗称红矾钠,在工业方面有广泛用途.我国目前主要是以铬铁矿
俗称红矾钠,在工业方面有广泛用途.我国目前主要是以铬铁矿![]() 主要成份为
主要成份为![]() ,还含有
,还含有![]() 、MgO、
、MgO、![]() 等杂质
等杂质![]() 为主要原料进行生产,其主要工艺流程如下:
为主要原料进行生产,其主要工艺流程如下:
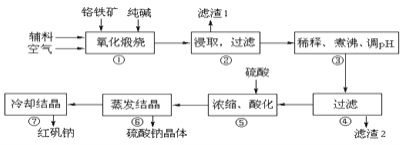
①中涉及的主要反应有:
主反应:![]()
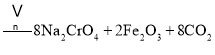
副反应: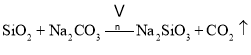 、
、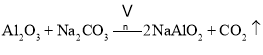
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
沉淀物 |
|
|
|
|
完全沉淀时溶液pH |
|
|
|
|
试回答下列问题:/span>
![]() “①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是 ______
“①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是 ______
![]() “③”中调节pH至
“③”中调节pH至![]() ,目的是 ______ .
,目的是 ______ .
![]() “⑤”中加硫酸酸化的目的是使
“⑤”中加硫酸酸化的目的是使![]() 转化为
转化为![]() ,请写出该平衡转化的离子方程式: ______ .
,请写出该平衡转化的离子方程式: ______ .
![]() 称取重铬酸钠试样
称取重铬酸钠试样![]() 配成250mL溶液,取出
配成250mL溶液,取出![]() 于碘量瓶中,加入10mL
于碘量瓶中,加入10mL![]() 和足量碘化钠
和足量碘化钠![]() 铬的还原产物为
铬的还原产物为![]() ,放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用
,放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用![]() 标准溶液滴定
标准溶液滴定![]()
①判断达到滴定终点的依据是: ______ ;
②若实验中共用去![]() 标准溶液
标准溶液![]() ,所得产品的中重铬酸钠晶体的纯度
,所得产品的中重铬酸钠晶体的纯度![]() 设整个过程中其它杂质不参与反应
设整个过程中其它杂质不参与反应![]() ______ .
______ .