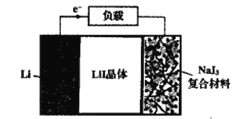
题目内容
【题目】氧化铬(Cr2O3)可用作有机合成的催化剂。某课题组以铬铁矿为主要原料制备Cr2O3。铬铁矿主要成分为Fe(CrO2)2,还含有Al2O3、SiO2等杂质,工艺流程如图所示。下列说法错误的是( )
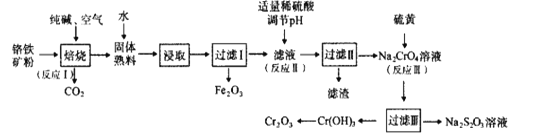
A.Fe(CrO2)2中Cr元素的化合价为+3
B.“焙烧”时,1molFe(CrO2)2参加反应转移4mole-
C.“滤渣”成份是Al(OH)3
D.“反应Ⅲ”的离子方程式为4CrO42-+6S+7H2O=4Cr(OH)3+3S2O32-+2OH-
【答案】BC
【解析】
铬铁矿为原料制备重铬酸钠,铬铁矿(主要成份为Fe(CrO2)2,还含有Al2O3、SiO2等杂质),铬铁矿经加入纯碱、空气和辅料氧化煅烧、主反应:4Fe(CrO2)2+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2,副反应:SiO2+Na2CO3
8Na2CrO4+2Fe2O3+8CO2,副反应:SiO2+Na2CO3![]() Na2SiO3+CO2↑、Al2O3+Na2CO3
Na2SiO3+CO2↑、Al2O3+Na2CO3![]() 2NaAlO2+CO2↑,水浸之后除去生成的氧化铁,加入稀硫酸调节pH,除去溶液中的AlO2-、SiO32-,经酸化、蒸发结晶后后可生成重铬酸钠,加入硫磺,发生氧化还原反应生成Cr(OH)3,分解生成Cr2O3,以此解答该题。
2NaAlO2+CO2↑,水浸之后除去生成的氧化铁,加入稀硫酸调节pH,除去溶液中的AlO2-、SiO32-,经酸化、蒸发结晶后后可生成重铬酸钠,加入硫磺,发生氧化还原反应生成Cr(OH)3,分解生成Cr2O3,以此解答该题。
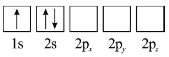
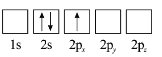
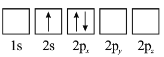
A.亚铬酸亚铁[Fe(CrO2)2]中Fe为+2价,O为-2价,由化合价代数和为0可知Cr的化合价是+3价,故A正确;
B.“焙烧”时,发生4Fe(CrO2)2+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2,4molFe(CrO2)2参加反应需要7mol氧气,转移28mol电子,则1molFe(CrO2)2参加反应转移7mol电子,故B错误;
8Na2CrO4+2Fe2O3+8CO2,4molFe(CrO2)2参加反应需要7mol氧气,转移28mol电子,则1molFe(CrO2)2参加反应转移7mol电子,故B错误;
C.由以上分析可知,“滤渣”成份是Al(OH)3、H2SiO3,故C错误;
D.硫磺在与铬酸钠的反应中转化为硫代硫酸钠,反应的离子方程式为4CrO42-+6S+7H2O=4Cr(OH)3↓+3S2O32-+2OH-,故D正确;
答案选BC。

 名校课堂系列答案
名校课堂系列答案