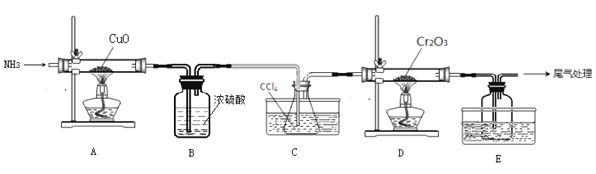
题目内容
【题目】甲烷水蒸气重整和水气变换是传统的制氢方法,反应如下 :
①CH4(g)+H2O(g)CO(g)+3H2 (g) △H1= 206kJmol-1
②CO(g)+H2O(g)CO2(g)+H2(g) △H2= - 4 1 kJmol-1
近期报道,用二氧化碳作为氧化剂和甲烷重整制氢的新反应路线如下,可生成适宜 H2/ CO 的合成气。
③CH4 (g)+CO2 (g)2CO(g)+2H2(g) △H3
(1)下列措施最有利于提高反应③CH4的平衡转化率条件是______________。
A. 升高温度,同时对原料气进行加压 B. 降低温度,同时对原料气进行加压
C. 升高温度,同时用氩气稀释原料气 D. 降低温度,同时用氩气稀释原料气
(2)重整反应器中以上三个反应都在发生,不同反应条件下达到平衡时的进程如下:
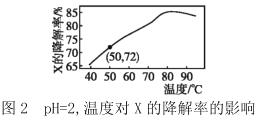
I.根据图1,在_________ ( 填写反应条件)时CO2的转化率为负值,主要原因:一是 CO2稳定性较高,低浓度时难以和甲烷反应;二是 ___________。
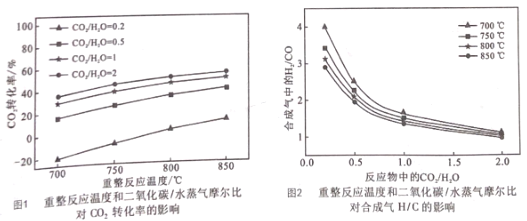
II.根据图,2随着反应温度和反应物中![]() 的提高,体系中反应____填①、②、③)逐渐占据主导。若 850℃、
的提高,体系中反应____填①、②、③)逐渐占据主导。若 850℃、![]() 为0.5时重整反应器中达到平衡时,体系中CO2和水蒸气浓度相等,求此条件下反应②的平衡常数K=__。
为0.5时重整反应器中达到平衡时,体系中CO2和水蒸气浓度相等,求此条件下反应②的平衡常数K=__。
(3)固体氧化物电解池(传导O2-)将CO2 和H2O 转化为n(H2):n(CO)=1的合成气并联产高纯度O2,写出电解池阴极反应式__________________。
【答案】C Ⅰ.反应温度低于 800℃、二氧化碳水蒸气摩尔比等于 0.2 相对较多的 H2O(g)以及较低的温度,使反应②平衡正向移动,反应③平衡逆向移动,CO2浓度上升 ③ 2 CO2+H2O+4e-=CO+H2+2O2-
【解析】
(1)根据盖斯定律判断反应③是吸热还是放热反应,提高CH4的平衡转化率,平衡正向移动,据此分析;
(2)I.结合图像1曲线的位置分析CO2的转化率为负值的条件;根据![]() 比值中,二氧化碳和水蒸气的所占比例对平衡移动的影响分析;
比值中,二氧化碳和水蒸气的所占比例对平衡移动的影响分析;
II.在![]() 不变的条件下,升高温度
不变的条件下,升高温度![]() 比值减小,反应②为放热反应,升高温度,平衡逆向移动;结合图像数据对应点数据,求解反应②平衡常数K;
比值减小,反应②为放热反应,升高温度,平衡逆向移动;结合图像数据对应点数据,求解反应②平衡常数K;
(3)根据题意,该电解池的总反应为CO2+H2O![]() H2+CO+O2,电解池中阳极失电子被氧化,阴极得电子被还原。
H2+CO+O2,电解池中阳极失电子被氧化,阴极得电子被还原。
(1)已知:①CH4(g)+H2O(g)CO(g)+3H2 (g) △H1= 206kJmol-1
②CO(g)+H2O(g)CO2(g)+H2(g) △H2= - 41 kJmol-1
根据盖斯定律,①-②=③,则③CH4 (g)+ CO2 (g) 2CO(g)+ 2H2(g) △H3=△H1-△H2=247 kJmol-1,故反应③是吸热反应,且正反应方向是气体体积增大的反应体系,要提高CH4的平衡转化率,则平衡需要正向移动,方法为升高温度,同时用氩气稀释原料气,答案选C;
(2)I.结合图像1曲线的位置分析CO2的转化率为负值的条件为:反应温度低于 800℃、![]() =0.2;
=0.2;![]() =0.2,说明水蒸气的含量大,相对较多的 H2O(g)以及较低的温度,使反应②平衡正向移动,反应③平衡逆向移动,CO2浓度上升;
=0.2,说明水蒸气的含量大,相对较多的 H2O(g)以及较低的温度,使反应②平衡正向移动,反应③平衡逆向移动,CO2浓度上升;
II.在![]() 不变的条件下,三个反应中,反应②为放热反应,升高温度,平衡逆向移动,氢气的量减少,一氧化碳的量增大,升高温度
不变的条件下,三个反应中,反应②为放热反应,升高温度,平衡逆向移动,氢气的量减少,一氧化碳的量增大,升高温度![]() 比值减小,升高温度反应①③正向移动,由于图像走向,
比值减小,升高温度反应①③正向移动,由于图像走向,![]() 比值趋向于1,故起主导的为反应③;
比值趋向于1,故起主导的为反应③;
若850℃、![]() 为 0. 5 时,,重整反应器中达到平衡时,体系中 CO2和水蒸气浓度相等,此时曲线上
为 0. 5 时,,重整反应器中达到平衡时,体系中 CO2和水蒸气浓度相等,此时曲线上![]() =2,即
=2,即![]() =2,反应CO(g)+ H2O(g)CO2(g) +H2(g) 的平衡常数K=
=2,反应CO(g)+ H2O(g)CO2(g) +H2(g) 的平衡常数K=![]() =2;
=2;
(3)根据题意,该电解池的总反应为CO2+H2O![]() H2+CO+O2,电解池中阳极失电子被氧化,阴极得电子被还原,固体氧化物电解池(传导O2-),阳极:2O2—4e-=O2,总反应减去阳极反应可得阴极反应为:CO2+H2O+4e-=CO+H2+2O2-。
H2+CO+O2,电解池中阳极失电子被氧化,阴极得电子被还原,固体氧化物电解池(传导O2-),阳极:2O2—4e-=O2,总反应减去阳极反应可得阴极反应为:CO2+H2O+4e-=CO+H2+2O2-。

 步步高达标卷系列答案
步步高达标卷系列答案【题目】溶液X 中含有下表中离子若干种,且离子浓度均为相等(不考虑水的电离与离子水解)。向X 中加入足量稀盐酸,有无色气体生成, 经分析反应前后阴离子种类没有变化,下列说法正确的是
阳离子 | Na+、Ca2+ 、Fe3+、Fe2+、Al3+、Mg2+ |
阴离子 | OH-、 |
A.溶液X 中可能有![]() 或
或![]() 中的一种或两种都有
中的一种或两种都有
B.溶液X 中是否有Na+不能确定,需通过焰色反应来确定
C.溶液X 中可能有2 种阳离子,3 种阴离子
D.原溶液一定没有Al3+、Fe 3+,但Na+,、![]() 不确定
不确定
【题目】下列离子方程式的书写及评价,均合理的是
选项 | 离子方程式 | 评价 |
A | 用铜电极电解饱和KCl溶液:2H2O+2Cl- | 正确:Cl-的失电子能力比OH-强 |
B | 向CuSO4溶液中通入过量的H2S气体:Cu2++H2S=CuS↓+2H+ | 错误:H2S的酸性比H2SO4弱 |
C | Ba(HCO3)2溶液与足量的NaOH溶液反应:Ba2++HCO3- +OH- ═BaCO3↓+H2O | 错误:Ba2+与HCO3-系数比应为1:2 |
D | 过量SO2通入到NaClO溶液中:SO2+ClO- +H2O= HClO+HSO3- | 正确:H2SO3的酸性比HClO强 |
A.AB.BC.CD.D