题目内容
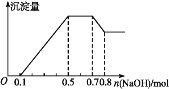
【题目】如图所示,Ⅰ、Ⅱ是两个完全相同的装置,分别装有10 mL相同浓度的盐酸,某学生分别在Ⅰ、Ⅱ的侧管中装入1.06 g Na2CO3和0.84 g NaHCO3,然后将两个侧管中的物质同时倒入各自的试管中,下列叙述正确的是
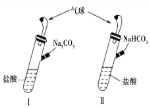
A. 装置Ⅰ的气球膨胀得快
B. 最终两试管中Na+、Cl-的物质的量分别相等
C. 若最终两气球体积不同,则盐酸的浓度一定小于或等于1 mol·L-1
D. 若最终两气球体积相同,则盐酸的浓度一定大于或等于2 mol·L-1
【答案】D
【解析】
A.根据1.06 g Na2CO3和0.84 g NaHCO3各与10 mL相同浓度的盐酸反应速率判断;
B. 根据最终两溶液中Na+、Cl-的物质的量判断;
C.根据1.06 g Na2CO3和0.84 g NaHCO3各与10 mL相同浓度的盐酸反应的原理判断;
D. 根据1.06 g Na2CO3和0.84 g NaHCO3各与10 mL相同浓度的盐酸反应的原理判断。
A.碳酸钠和盐酸反应分步进行,先生成碳酸氢钠,后碳酸氢钠和盐酸反应生成二氧化碳,所以甲装置的气球膨胀速率小,故A错误;
B. 1.06 g Na2CO3和0.84 g NaHCO3的物质的量相同,都是0.01mol,所以Na2CO3和NaHCO3中钠离子的物质的量不同,故最终两试管中的Na+物质的量一定不相同,故B错误;
C.碳酸钠和盐酸反应的离子方程式为:CO32-+H+=HCO3-,HCO3-+H+=H2O+CO2↑,碳酸氢钠和盐酸反应的离子方程式为HCO3-+H+=H2O+CO2↑;若最终两气球体积不同,所需酸的物质的量范围是:0<c(HCl)<0.02mol/L,所以其浓度大于0小于2mol/L,故C错误;
D. 1.06 g Na2CO3和0.84 g NaHCO3的物质的量相同,都是0.01mol,根据方程式知:NaHCO3+HCl=NaCl+H2O+CO2↑,Na2CO3+2HCl=2NaCl+H2O+CO2↑,若最终两气球体积相同,说明酸的物质的量大于或等于0.02mol,所以其浓度大于或等于2mol/L,故D正确。
故选D。

【题目】氧化锌是一种常用添加剂,广泛应用于塑料、合成橡胶、电池等产品的制造。一种利用氧化锌烟灰制备活性氧化锌的工艺流程如下:
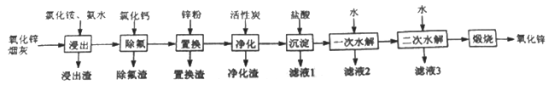
已知:I.氧化锌烟灰的主要化学组成如下:
元素组成 | Zn Pb Cu Cl F |
质量分数/% | 59.78 9.07 0.30 2.24 1.80 |
II.“浸出”时,大部分锌元素以Zn(NH3)42+ 形式进入溶液,同时部分Pb、Cu、F元素也进入溶液中。
(1)Zn的原子序数为30,其在元素周期表中的位置为__________。
(2)“浸出”时,氧化锌发生反应的离子方程式为_______________________;“浸出”时温度不宜过高,其原因为____________________________________________。
(3)若“浸出”后,所得溶液中c(F-)=0.02mol·L-1,向其中加入等体积的氯化钙溶液(忽略溶液体积变化),使F- 沉淀完全即溶液中c(F-)<10-5 mol·L-1,则所加氯化钙溶液的浓度度最小为_____________。已知:Ksp((CaF2)=3.45×10-11
(4)“置换”时,所得置换渣中除了含Zn外,还含有___________;“净化”时,利用活性炭的_________性,除去溶液中残留的有机物。
(5)“沉淀”时,可得到滤渣Zn(NH3)Cl2。所加盐酸过量时,会导致沉淀部分溶解甚至消失,其化学方程式为_________________________________。
(6)将滤液1和滤液2合并,经浓缩后,可返回至__________(填流程中的操作名称)循环利用。
(7)“一次水解”时,产物为Zn(OH)xCly,。取10.64g该水解产物,经二次水解、煅烧后,可得活性氧化锌8.1 g(假设各步均转化完全)。则一次水解产物的化学式为_____________。