题目内容
【题目】二甲醚(CH3OCH3)是一种重要的清洁燃料气,其储运、燃烧安全性、理论燃烧温度等性能指标均优于液化石油气,也可用作燃烧电池,具有很好的发展前景。
(1)已知 H2、CO 和CH3OCH3的燃烧热(ΔH)分别为-285.5kJ/mol、 -283kJ/mol 和-1460.0kJ/mol,则工业上利用水煤气成分按 1:1 合成二甲醚的热化学方程式为: ____________。
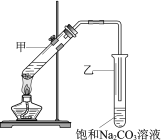
(2)工业上采用电浮远凝聚法处理污水时,保持污水的pH在5.0,通过电解生成 Fe(OH)3胶体,吸附不溶性杂质,同时利用阴极产生的 H2,将悬浮物带到水面,利于除去。实验室以二甲醚燃料电池模拟该方法设计的装置如下图所示:
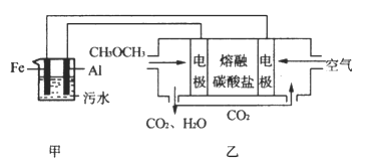
①乙装置以熔融碳酸盐为电解质,稀土金属材料为电极。写出该燃料电池的正极电极反应式 __________;下列物质可用做电池熔融碳酸盐的是 ______。
A.MgCO3 B.Na2CO3 C.NaHCO3 D.(NH4)2CO3
②写出甲装置中阳极产物离子生成Fe(OH)3沉淀的离子方程式____________________。
③已知常温下 Ksp[Fe(OH)3]=4.0×10-38,电解一段时间后,甲装置中 c(Fe3+)=___________。
④已知:H2S的电离平衡常数: K1=9.1×10-8、 K2=1.1×10-12; H2CO3的电离平衡常数:K1=4.31×10-7、 K2=5.61×10-11。测得电极上转移电子为 0.24mol 时,将乙装置中生成的 CO2通入200mL 0.2mol/L的Na2S溶液中,下列选项正确的是______
A.发生反应的离子方程式为:CO2+S2-+H2O=CO32-+H2S
B.发生反应的离子方程式为: CO2+S2-+H2O=HCO3-+HS-
C.c(Na+)=2[c(H2S)+c(HS-)+c(S2-)
D.c(Na+)+c(H+)=2c(CO32-)+2c(S2-)+c(OH-)
E. c(Na+)>c(HCO3-)>c(HS-)>c(OH-)
【答案】2H2(g)+3CO(g)=CH3OCH3(g)+CO2(g) △H=-246.4 kJ·mol-1 O2+4e-+2CO2=2CO32- B 4Fe2++O2+10H2O=4Fe(OH)3+8H+ 4.0×10-11mol/L B、C、E
【解析】
(1)①H2(g)+![]() O2(g)=H2O(l)△H=-285.5kJ/mol,②CO(g)+
O2(g)=H2O(l)△H=-285.5kJ/mol,②CO(g)+![]() O2(g)=CO2(g)△H=-283kJ/mol,③CH3OCH3(g)+3O2=2CO2(g)+3H2O(l)△H=-1460.0kJ/mol
O2(g)=CO2(g)△H=-283kJ/mol,③CH3OCH3(g)+3O2=2CO2(g)+3H2O(l)△H=-1460.0kJ/mol
用水煤气成分按1:1合成二甲醚,将方程式3①+3②-③得:3H2(g)+3CO(g)=CH3OCH3(g)+CO2(g)△H=3(-285.5kJ/mol)+3(-283kJ/mol)-(-1460.0kJ/mol)=-245.5kJ/mol,故答案为3H2(g)+3CO(g)=CH3OCH3(g)+CO2(g)△H=-245.5kJmol-1;
(2)①燃料电池中,正极上氧化剂氧气得电子和二氧化碳发生还原反应生成碳酸根离子,电极反应式为O2+4e-+2CO2=2CO32-;熔融碳酸盐性质要稳定,高温时不能分解生成其它物质,A.MgCO3高温下分解生成氧化镁和二氧化碳而得不到碳酸根离子,故错误; B.Na2CO3性质较稳定,熔融状态下只发生电离而不发生分解反应,故正确;C.NaHCO3性质不稳定,易分解而得不到碳酸根离子,故错误;D.(NH4)CO3性质不稳定,易分解而得不到碳酸根离子,故错误;故答案为O2+4e-+2CO2=2CO32-;B;
②阳极上Fe失电子生成亚铁离子,阴极上生成氢氧根离子,亚铁离子和氢氧根离子反应生成氢氧化亚铁,氢氧化亚铁不稳定,被氧气氧化生成氢氧化铁,离子反应方程式为:4Fe2++O2+10H2O=4Fe(OH)3↓+8H+,故答案为4Fe2++O2+10H2O=4Fe(OH)3↓+8H+;
③c(Fe3+)=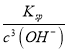 =
= mol/L=4.0×10-11 mol/L,故答案为4.0×10-11mol/L;
mol/L=4.0×10-11 mol/L,故答案为4.0×10-11mol/L;
④乙装置中阴极上甲醚失电子生成二氧化碳,根据CH3OCH3---2CO2---12e-计算n(CO2)=![]() =0.04mol,n(Na2S)=0.2mol/L×0.2L=0.04mol,根据电离平衡常数知发生反应CO2+S2-+H2O═HCO3-+HS-,则溶液中的溶质是等物质的量浓度的NaHCO3、NaHS,A.根据以上分析知,发生反应的离子方程式为:CO2+S2-+H2O═HCO3-+HS-,故错误;B.根据以上分析知,发生反应的离子方程式为:CO2+S2-+H2O═HCO3-+HS-,故正确;C.根据物料守恒得c(Na+)=2[c(H2S)+c(HS-)+c(S2-)],故正确;D.根据电荷守恒得c(Na+)+c(H+)=2c(CO32-)+2c(S2-)+c(OH-)+c(HS-)+c(HCO3
=0.04mol,n(Na2S)=0.2mol/L×0.2L=0.04mol,根据电离平衡常数知发生反应CO2+S2-+H2O═HCO3-+HS-,则溶液中的溶质是等物质的量浓度的NaHCO3、NaHS,A.根据以上分析知,发生反应的离子方程式为:CO2+S2-+H2O═HCO3-+HS-,故错误;B.根据以上分析知,发生反应的离子方程式为:CO2+S2-+H2O═HCO3-+HS-,故正确;C.根据物料守恒得c(Na+)=2[c(H2S)+c(HS-)+c(S2-)],故正确;D.根据电荷守恒得c(Na+)+c(H+)=2c(CO32-)+2c(S2-)+c(OH-)+c(HS-)+c(HCO3

【题目】碳氧化物研究
![]() 和
和![]() 在一定条件下可以合成甲醇:
在一定条件下可以合成甲醇:![]() ,现在体积为1L的恒容密闭容器
,现在体积为1L的恒容密闭容器![]() 图甲
图甲![]() 中通入1molCO和
中通入1molCO和![]() ,测定不同时间、不同温度
,测定不同时间、不同温度![]() 下容器中CO的物质的量,如表:
下容器中CO的物质的量,如表:

0min | 10min | 20min | 30min | 40min | |
| 1mol |
|
|
|
|
| 1mol |
|
| a | a |
请回答:
![]() ______
______![]() 填“
填“![]() ”或“
”或“![]() ”或“
”或“![]() ”
”![]() ,理由是______。已知
,理由是______。已知![]() 时,第20min时容器内压强不再改变,此时
时,第20min时容器内压强不再改变,此时![]() 的转化率为______,该温度下的化学平衡常数为______。
的转化率为______,该温度下的化学平衡常数为______。
![]() 若将1molCO和
若将1molCO和![]() 通入原体积为1L的恒压密闭容器
通入原体积为1L的恒压密闭容器![]() 图3乙
图3乙![]() 中,在
中,在![]() 下达到平衡,此时反应的平衡常数为______;若再向容器中通入
下达到平衡,此时反应的平衡常数为______;若再向容器中通入![]() ,重新达到平衡后,
,重新达到平衡后,![]() 在体系中的百分含量______
在体系中的百分含量______![]() 填“变大”或“变小”或“不变”
填“变大”或“变小”或“不变”![]() 。
。
![]() 一定条件下也可用NaOH溶液与CO反应生成甲酸钠,进一步反应生成甲酸来消除CO污染。常温下将amol的CO通入
一定条件下也可用NaOH溶液与CO反应生成甲酸钠,进一步反应生成甲酸来消除CO污染。常温下将amol的CO通入![]() NaOH溶液中,恰好完全反应生成甲酸钠和含少量甲酸的混合溶液
NaOH溶液中,恰好完全反应生成甲酸钠和含少量甲酸的混合溶液![]() 假设溶液体积不变
假设溶液体积不变![]() ,测得溶液中
,测得溶液中![]() ,则该混合溶液中甲酸的电离平衡常数
,则该混合溶液中甲酸的电离平衡常数![]() ______
______![]() 用含a和b的代数式表示
用含a和b的代数式表示![]()