题目内容
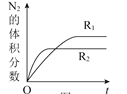
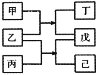
【题目】短周期元素W、X、Y、Z原子序数依次增大,甲、乙、丙、丁、戊、己是由这些元素构成的物质。常温下,丙和戊是单质气体,乙为生活中常见的无色液体,戊能使带火星的木条复燃,0.01mol/L丁溶液pH=12,上述物质的转化关系如图所示.下面说法正确的是
A.原子半径:X<Y<ZB.单质沸点:W>X
C.气态氢化物的热稳定性:X>YD.Y和Z形成的化合物溶于水显碱性
【答案】D
【解析】
短周期元素W、X、Y、Z原子序数依次增大,甲、乙、丙、丁、戊、己是由这些元素构成的物质。常温下,丙和戊是单质气体,乙为生活中常见的无色液体,乙为H2O,戊能使带火星的木条复燃,戊为O2,0.01mol/L丁溶液pH=12,丁是强碱,为NaOH,根据图中物质的转化关系得:乙+丙=戊+己,丙为F2,己为HF,又甲+乙=丁+戊得:甲为Na2O2,短周期元素W、X、Y、Z原子序数依次增大,整理得 W为H、X为O、Y为F、Z为Na,甲为Na2O2、乙为H2O、丙为F2、丁为NaOH、戊为O2、己为HF。
A. 同周期从左到右,原子半径逐渐减小,原子半径应为:Y<X<Z,故A错误;
B. 分子晶体,相对分子质量越大,单质沸点越高,氢气的相对分子质量为2,氧气分子质量为32,单质沸点:W<X,故B错误;
C. 同周期从左到右,气态氢化物稳定性增强,气态氢化物的热稳定性:X<Y,故C错误;
D. Y和Z形成的化合物NaF属于强碱弱酸盐,溶于水后水解,水溶液显碱性,故D正确;
故选D。

【题目】经测定乙醇的分子式是![]() ,由于有机化合物普遍存在同分异构现象,推测乙醇分子的结构可能是下列两种之一:
,由于有机化合物普遍存在同分异构现象,推测乙醇分子的结构可能是下列两种之一:
Ⅰ.  Ⅱ.
Ⅱ. 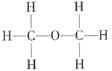
为确定其结构,应利用物质的特殊性质进行定性、定量实验。现给出乙醇、钠、水及必要的仪器,甲、乙、丙三名学生利用如图所示装置进行实验确定乙醇分子的结构。图中量气装置由甲、乙两根玻璃管组成,它们用橡皮管连通,并装入适量水。甲管有刻度(0~200mL),供量气用;乙管可上下移动,以调节液面高低。

(1)学生甲得到一组实验数据;
乙醇的物质的量 | 氢气的体积(标准状况下) |
0.01mol | 0.112L |
根据以上数据推断,乙醇的结构应为___________________(填“Ⅰ”或“Ⅱ”),原因是_______________
(2)学生乙认为:为了较准确地测量氢气的体积,除了必须检查整个装置的气密性外,在读取反应前后甲管中液面读数的过程中,应注意___________________(填序号)。
a.视线与凹液面最低处相平
b.等待片刻,待乙管中液面不再上升时,立刻读数
c.读数时应上下移动乙管,使甲、乙两管液面相平
d.读数时不一定使甲、乙两管液面相平
【题目】过氧化钠可作为氧气的来源。常温常压下二氧化碳和过氧化钠反应后,若固体质量增加了28 g,反应中有关物质的物理量正确的是(NA表示阿伏加德罗常数)
二氧化碳 | 碳酸钠 | 转移的电子 | |
A | 1mol | NA | |
B | 22.4L | 1mol | |
C | 106 g | 1mol | |
D | 106g | 2NA |
A.AB.BC.CD.D