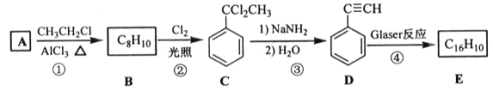
题目内容
【题目】碳氧化物研究
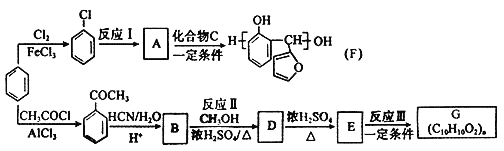
![]() 和
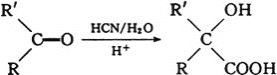
和![]() 在一定条件下可以合成甲醇:
在一定条件下可以合成甲醇:![]() ,现在体积为1L的恒容密闭容器
,现在体积为1L的恒容密闭容器![]() 图甲
图甲![]() 中通入1molCO和
中通入1molCO和![]() ,测定不同时间、不同温度
,测定不同时间、不同温度![]() 下容器中CO的物质的量,如表:
下容器中CO的物质的量,如表:

0min | 10min | 20min | 30min | 40min | |
| 1mol |
|
|
|
|
| 1mol |
|
| a | a |
请回答:
![]() ______
______![]() 填“
填“![]() ”或“
”或“![]() ”或“
”或“![]() ”
”![]() ,理由是______。已知
,理由是______。已知![]() 时,第20min时容器内压强不再改变,此时
时,第20min时容器内压强不再改变,此时![]() 的转化率为______,该温度下的化学平衡常数为______。
的转化率为______,该温度下的化学平衡常数为______。
![]() 若将1molCO和
若将1molCO和![]() 通入原体积为1L的恒压密闭容器
通入原体积为1L的恒压密闭容器![]() 图3乙
图3乙![]() 中,在
中,在![]() 下达到平衡,此时反应的平衡常数为______;若再向容器中通入
下达到平衡,此时反应的平衡常数为______;若再向容器中通入![]() ,重新达到平衡后,
,重新达到平衡后,![]() 在体系中的百分含量______
在体系中的百分含量______![]() 填“变大”或“变小”或“不变”
填“变大”或“变小”或“不变”![]() 。
。
![]() 一定条件下也可用NaOH溶液与CO反应生成甲酸钠,进一步反应生成甲酸来消除CO污染。常温下将amol的CO通入
一定条件下也可用NaOH溶液与CO反应生成甲酸钠,进一步反应生成甲酸来消除CO污染。常温下将amol的CO通入![]() NaOH溶液中,恰好完全反应生成甲酸钠和含少量甲酸的混合溶液
NaOH溶液中,恰好完全反应生成甲酸钠和含少量甲酸的混合溶液![]() 假设溶液体积不变
假设溶液体积不变![]() ,测得溶液中
,测得溶液中![]() ,则该混合溶液中甲酸的电离平衡常数
,则该混合溶液中甲酸的电离平衡常数![]() ______
______![]() 用含a和b的代数式表示
用含a和b的代数式表示![]()
【答案】![]() 温度越高,反应速率越快,在其他条件相同时,
温度越高,反应速率越快,在其他条件相同时,![]() 时的反应速率比
时的反应速率比![]() 时的反应速率快
时的反应速率快 ![]() 1
1 ![]() 不变
不变 ![]()
【解析】
根据温度越高,反应速率越快,结合表格中数据进行判断![]() 的大小;根据平衡概念判断平衡;根据转化率公式计算氢气的转化率;根据平衡常数公式计算平衡常数。
的大小;根据平衡概念判断平衡;根据转化率公式计算氢气的转化率;根据平衡常数公式计算平衡常数。
I.![]() 温度越高,反应速率越快,表格中可以看出
温度越高,反应速率越快,表格中可以看出![]() 温度下的反应速率比
温度下的反应速率比![]() 时的反应速率快,所以
时的反应速率快,所以![]() ;已知
;已知![]() 时,第20min时容器内压强不再改变,说明反应达到平衡状态,此时消耗
时,第20min时容器内压强不再改变,说明反应达到平衡状态,此时消耗![]() 物质的量
物质的量![]() ,氢气转化率
,氢气转化率![]() ,平衡时,CO剩余
,平衡时,CO剩余![]() /L,
/L,![]() 剩余1mol/L,根据
剩余1mol/L,根据![]() 方程式可知,
方程式可知,![]() 为
为![]() ,所以
,所以![]() ,
,
故答案为:![]() ;温度越高,反应速率越快,在其他条件相同时,
;温度越高,反应速率越快,在其他条件相同时,![]() 时的反应速率比
时的反应速率比![]() 时的反应速率快;
时的反应速率快;![]() ;1;
;1;
![]() 若将1molCO和
若将1molCO和![]() 通入原体积为1L的恒压密闭容器
通入原体积为1L的恒压密闭容器![]() 图3乙
图3乙![]() 中,在
中,在![]() 下达到平衡,平衡常数只随温度变化,此时反应的平衡常数仍为1;再次加入
下达到平衡,平衡常数只随温度变化,此时反应的平衡常数仍为1;再次加入![]() ,恒压容器,达到等效平衡,所以
,恒压容器,达到等效平衡,所以![]() 的百分含量不变;故答案为:1;不变;
的百分含量不变;故答案为:1;不变;
![]() 反应平衡时,
反应平衡时,![]() ,据电荷守恒可知:
,据电荷守恒可知:![]() ,则甲酸电离平衡常数为
,则甲酸电离平衡常数为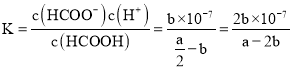 ,
,
故答案为:![]() 。
。

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案