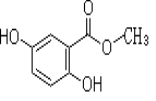
题目内容
【题目】钡盐生产中排出大量的钡泥[主要含BaCO3、BaSO3、Ba(FeO2)2等],某主要生产BaCO3的化工厂利用钡泥制取Ba(NO3)2晶体及其他副产物,其部分工艺流程如下:
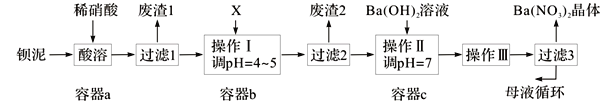
已知:i .Fe(OH)3和Fe(OH)2完全沉淀时,溶液的pH分别为3.2和9.7。
ii .Ba(NO3)2在热水中溶解度较大,在冷水中溶解度较小。
iii. Kap(BaSO4)=1.1×10-10,Ksp(BaCO3)=5.1×10-9。
(1)Ba(FeO2)2中Fe的化合价是 。
(2)二氧化碳与水作用形成的碳酸在水中的电离常数Ka1=4.2×10-7 ,Ka2=5.6×10-11;次氯酸在水中的电离常数Ka =4.7×10-8。写出向“84消毒液”(主要成分为氯化钠和次氯酸钠)中通入二氧化碳发生反应的离子方程式 。
(3)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和Na2CO3溶液中,充分搅拌,过滤,洗涤。用离子方程式和必要的文字说明提纯原理: 。
(4)上述流程酸溶时,Ba(FeO2)2与HNO3反应生成两种硝酸盐,化学方程式为: 。
(5)该厂结合本厂实际,选用的X为 (从下列选项中选择);废渣2为 (写出化学式)。
① BaCl2 ②Ba(NO3)2 ③BaCO3 ④ Ba(OH)2
(6)过滤3后的母液应循环到容器 中。(填“a”、“b”或“c”)
(7)称取w g晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量沉淀质量为m g,则该Ba(NO3)2的纯度为 。
【答案】
(1)+3
(2)ClO-+ CO2 + H2O=HClO + HCO3-
(3)BaSO4(s)+CO32-(aq) ![]() BaCO3(s)+SO42-(aq),增大碳酸根离子的浓度,使平衡正向移动从而除去BaSO4杂质
BaCO3(s)+SO42-(aq),增大碳酸根离子的浓度,使平衡正向移动从而除去BaSO4杂质
(4)Ba(FeO2)2+8HNO3 = Ba(NO3)2+2Fe(NO3)3+4H2O;
(5)③; Fe(OH)3;
(6)c;
(7)![]() ×100%
×100%
【解析】
试题分析:
(1)Ba为+2价,O为-2价,根据化合价规则可得Fe为+3价;
(2)酸越弱,电离常数越小,所以根据电离常数可知酸性强弱顺序为碳酸>次氯酸>碳酸氢钠,所以依据较强酸制备较弱酸可知向“84消毒液”(主要成分为氯化钠和次氯酸钠)中通入少量二氧化碳发生反应的离子方程式为ClO-+ CO2 + H2O=HClO + HCO3-;
(3)在溶液中存在平衡:BaSO4(s)+CO32-(aq) ![]() BaCO3(s)+SO42-(aq),加入饱和的碳酸钠溶液,增大碳酸根离子的浓度,使平衡正向移动生成碳酸钡而除去BaSO4杂质;
BaCO3(s)+SO42-(aq),加入饱和的碳酸钠溶液,增大碳酸根离子的浓度,使平衡正向移动生成碳酸钡而除去BaSO4杂质;
(4)Ba(FeO2)2与HNO3反应生成两种硝酸盐,则根据原子守恒两种硝酸盐应该是硝酸铁和硝酸钡,同时还有水生成,反应的化学方程式为Ba(FeO2)2+8HNO3 = Ba(NO3)2+2Fe(NO3)3+4H2O;
(5)X是调节溶液pH,以沉淀溶液中的铁离子,由于不能引入杂质,实验根据本长的实际应该选择碳酸钡,答案选③;氢氧化铁在pH=3.2时就已经完全沉淀,则滤渣2的主要成分是Fe(OH)3;
(6)过滤3后的母液中含有氢氧化钡,因此应循环到容器c中;
(7)mg沉淀应该是硫酸钡,则碳酸钡的质量是![]() ,所以其纯度为
,所以其纯度为![]() ×100%。
×100%。