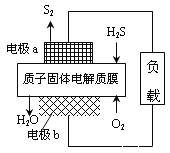
题目内容
【题目】
砷主要以硫化物矿的形式(如雄黄,雌黄等)存在于自然界。砷及其化合物主要用于合金冶炼、农药医药、颜料等工业。请根据有关砷及其化合物的转化关系和晶体结构图,回答下列问题:

(1)量子力学把电子在原子核外的一个空间运动状态称为一个原子轨道,电子除空间运动状态外,还有一种运动状态叫做__________________。
(2)基态砷原子的核外电子排布式为_______________,与砷同周期的p区元素中第一电离能大于砷的元素有_______________ (填元素符号)。
(3)雄黄分子中,As原子的杂化方式为_________________。
(4)雄黄可经过如下三步反应生成雌黄:

①反应Ⅲ的化学方程式为________________________。
②SO2的中心原子的VSEPR构型为______________________。
③亚砷酸属于三元弱酸,酸性:H3AsO3________HNO2(填“>”或“<”),请根据物质结构的知识解释原因:____________________________。
(5)①图3是由Li、Fe和As三种元素组成的超导体化合物的晶体结构(该晶胞是立方晶胞,Li在晶胞内部),该晶体的化学式为_____________________。
②若1号原子的坐标为(0,0,0),2号原子的坐标为(1/4,1/4,1/3),则3号原子的坐标为___________。
③已知该晶胞参数ɑ=0.53nm,阿伏加德罗常数的值为NA,则该晶体的密度为_______g·cm-3(列出计算式即可)。
【答案】 自旋 1s22s22p63s23p63d104s24p3或[Ar]3d104s24p3 Br、Kr sp3 2H3AsO3+3H2S=As2S3+6H2O 平面三角形 < 氮的电负性强于砷另外H3AsO3的结构为(HO)3As非羟基氧的个数为0HNO2的结构为(HO)NO非羟基氧的个数为1非羟基氧的个数越多中心原子的正电性越高导致羟基氧中氧的电子向中心原子偏移越容易电离出氢离子故HNO2的酸性强于H3AsO3 LiFeAs (3/4,1/4,2/3) ![]()
【解析】考查物质结构与性质综合知识的运用,(1)量子力学把电子在原子核外的一个空间运动状态称为一个原子轨道,电子除空间运动状态外,还有一种运动状态称为自旋;(2)As位于第四周期VA族,基态核外电子排布式为1s22s22p63s23p63d104s24p3或[Ar]3d104s24p3 ;同周期从左向右第一电离能增大,但IIA>IIIA、VA>VIA,因此第一电离能大于As元素的是Br和Kr;(3)根据雄黄的结构简式,As有3个σ键,一个孤电子对,因此As的杂化类型为sp3;(4)①根据雌黄的结构,推出雌黄的分子式为As2S3,根据III的流程,因此方程式为2H3AsO3+3H2S=As2S3+6H2O;②SO2中心原子有2个σ键,孤电子对数为(6-2×2)/2=1,价层电子对数为3,因此VSEPR模型为平面三角形;③H3AsO3为三元弱酸,不含有非羟基氧,HNO2中含有1个非羟基氧,非羟基氧越多,中心原子的正电性越高导致羟基氧中氧的电子向中心原子偏移越容易电离出氢离子故HNO2的酸性强于H3AsO3;(5)①根据晶胞的结构,Li位于晶胞内部,有4个,Fe位于顶点、棱上、面上,个数为8×1/8+8×1/4+2×1/2=4,As位于晶胞的内部,个数为4个,因此化学式为LiFeAs;②根据1号和2号原子的坐标,推出3号原子坐标为(3/4,1/4,2/3);③晶胞的质量为4×138/NAg,晶胞的体积为(0.53×10-7)3cm3,根据密度的定义,得出晶胞的密度为![]() g/cm3。
g/cm3。

 阅读快车系列答案
阅读快车系列答案【题目】电子垃圾中含有大量的废弃塑料和重金属,工业上可以从电子废料(电脑主板和手机废件)中提取大量的金、银和铜,每吨电子废料中能够提取出130公斤铜,0.45公斤黄金和2公斤白银,提取流程如下:

请回答下列问题:
(1)“酸溶”过程中,王水与金反应的化学方程式为________________________。
(2)“萃取”过程中,将混合液分离所需要的主要仪器为____________________,该仪器在使用前必须进行的操作为____________________________。
(3)“还原Ⅰ”制备单质Ag的过程中,发生反应的本质是Zn和AgCl在电解质HCl中形成微电池,该过程的总反应为:2AgCl+Zn=2Ag+ZnCl2,则该电池正极的电极反应式为__________________________。
(4)滤渣的主要成分为Cu2(OH)2CO3,则“沉铜”过程中发生反应的离子方程式为______________________。
(5)滤液为NaCl、Na2CO3和NaHCO3的混合液,若上述三种物质的物质的量浓度相同,则溶液中各离子浓度的大小顺序为______________________。
(6)根据下表中数据,综合分析工业上进行“还原Ⅱ”过程中所选用的还原剂最好为______________。
物质 | 价格(元·吨-1) |
双氧水(含30%H2O2) | 3200 |
绿矾(含99.0%FeSO4·7H2O) | 1800 |
亚硫酸氢钠(含99.5%NaHSO3) | 2850 |
草酸(含99.0%H2C2O4) | 3000 |