��Ŀ����
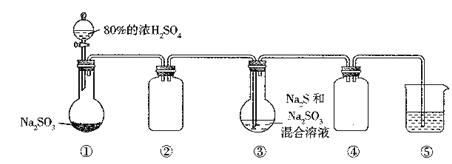
����Ŀ�����������к��д����ķ������Ϻ��ؽ�������ҵ�Ͽ��Դӵ��ӷ���(����������ֻ��ϼ�)����ȡ�����Ľ�����ͭ��ÿ�ֵ��ӷ������ܹ���ȡ��130����ͭ��0.45����ƽ��2�����������ȡ�������£�

��ش��������⣺
(1)�����ܡ������У���ˮ���Ӧ�Ļ�ѧ����ʽΪ________________________��
(2)����ȡ�������У������Һ��������Ҫ����Ҫ����Ϊ____________________����������ʹ��ǰ������еIJ���Ϊ____________________________��
(3)����ԭ���Ʊ�����Ag�Ĺ����У�������Ӧ�ı�����Zn��AgCl�ڵ����HCl���γ���أ��ù��̵��ܷ�ӦΪ��2AgCl+Zn=2Ag+ZnCl2����õ�������ĵ缫��ӦʽΪ__________________________��
(4)��������Ҫ�ɷ�ΪCu2(OH)2CO3����ͭ�������з�����Ӧ�����ӷ���ʽΪ______________________��
(5)��ҺΪNaCl��Na2CO3��NaHCO3�Ļ��Һ���������������ʵ����ʵ���Ũ����ͬ������Һ�и�����Ũ�ȵĴ�С˳��Ϊ______________________��
(6)�����±������ݣ��ۺϷ�����ҵ�Ͻ��С���ԭ��������ѡ�õĻ�ԭ�����Ϊ______________��
���� | �۸�Ԫ����-1�� |
˫��ˮ����30%H2O2�� | 3200 |
�̷�����99.0%FeSO4��7H2O�� | 1800 |
���������ƣ���99.5%NaHSO3�� | 2850 |
���ᣨ��99.0%H2C2O4) | 3000 |
���𰸡� Au+HNO3+4HCl=HAuCl4+2H2O+NO�� ��Һ©�� ��© AgCl+e-=Ag+Cl- 2Cu2++3CO32-+2H2O=Cu2(OH)2CO3��+2HCO3- c(Na+)>c(HCO3-)>c(Cl-)>c(CO32-)>c(OH-)>c(H+) ����
�����������黯ѧ�������̣���1�������ܡ������У���ˮ��HNO3��HCl�Ļ���Auת����HAuCl4��HNO3��Nת����NO�������Au��HNO3��HCl��HAuCl4��NO����H2O��Ȼ����ݻ��ϼ�������������ƽ������ѧ��Ӧ����ʽΪAu+HNO3+4HCl=HAuCl4+2H2O+NO������2����ȡʱ�õ�����Ҫ�����Ƿ�Һ©�����ձ���ʹ�÷�Һ©��ʱ��������֤��Һ©���Ƿ�©Һ����3������ԭ��صĹ���ԭ���������ϵõ����ӣ����ϼ۽��ͣ������ܷ�Ӧ���ó�������ӦʽΪAgCl��e��=Ag��Cl������4����ͭʱ����CuCl2��Һ�ּ���������Na2CO3��Һ������Cu2(OH)2CO3�����ݣ�5������ʾ����Һ�����µ�������NaHCO3������ͭʱ����NaHCO3������ͭʱ�����ӷ���ʽΪ2Cu2��+ 3CO32��+2H2O= Cu2(OH)2CO3��+2HCO3�� ����5���������ʵ�����ͬ��c(Na��)��࣬��ΪCO32����ˮ��̶ȴ���HCO3����ˮ��̶ȣ����c(HCO3��)>c(Cl��)>c(CO3��)��CO32��ˮ�����Һ�Լ��ԣ���c(OH��)>c(H��)��ˮ��̶������������Ũ�ȴ�С˳����c(Na��)>c(HCO3��)>c(Cl��)>c(CO32��)>c(OH��)>c(H��)����6��H2O2��H2O2�����ͣ��Ҽ۸����˲�ѡH2O2���̷�����Ȼ�۸���ˣ������ݵ�ʧ������������������ʵ������̷��Ͳ�����ȣ���ԭЧ�����һ�����ٽ����Է������������Եó�������̷��ijɱ��ͣ����������ƣ��п��ܲ���SO2���Ի���������Ⱦ����˻�ԭ����õ��Dz��ᡣ

 ����ѧ����ϵ�д�
����ѧ����ϵ�д�