题目内容
【题目】某再回收利用公司对一厨房铁铝合金废旧家具进行回收利用,其流程如下图所示:
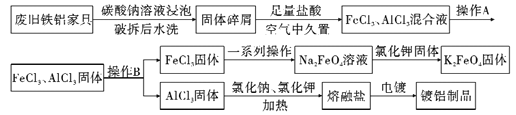
请回答下列问题:
(1)流程中加碳酸钠溶液浸泡的目的是_______________;在空气中久置的目的是_________________。
(2)同条件下Na2FeO4溶解度__________K2FeO4溶解度(填“低于”,“高于”, “不确定”),推测K2FeO4在净水方面的作用_______________。(至少答两条)
(3)已知K2FeO4水解显碱性。在洗涤K2FeO4固体时最好选用__________。
A.水 B.亚硫酸氢钠溶液 C.氢氧化钠溶液 D.先氢氧化钠溶液后乙醇
(4)熔融盐电镀中铝元素和氯元素主要以AlCl4-和Al2Cl7-形式存在,铝电镀的主要电极反应式为___________________。(写出一个电极反应即可)
(5)已知氯化铝受热易升华,气态氯化铝的密度为11.92g/L(已转化为标准状况),则气态氯化铝的分子式为______________________。
(6)氢氧化铝经常用于做药品,有两种溶解方式:可以溶解为Al3+或[Al(OH)4]-。已知25℃时氢氧化铝在pH=3和pH=10的两溶液中溶解度均为7.8×10-3g(溶液密度近似为1g/mL),则25℃下氢氧化铝的两种溶解方式的溶度积之比为____________。
【答案】 除油污 利用空气中的氧气将亚铁氧化为三价铁 高于 杀菌消毒、吸附悬浮物 D 7AlCl4+Al-3e=4Al2Cl7或相反 Al2Cl6 1023或10-23
【解析】(1) 铁铝合金废旧家具用碳酸钠溶液浸泡可以除去表面的油脂;铁铝合金粉碎后用盐酸溶解生成氯化铝和氯化亚铁,在空气中久置可以将将亚铁氧化为三价铁,故答案为:除油污;利用空气中的氧气将亚铁氧化为三价铁;
(2)根据流程图,Na2FeO4溶液中加入氯化钾固体反应生成K2FeO4固体,说明同条件下Na2FeO4溶解度高于K2FeO4溶解度,K2FeO4中铁为+6价,具有强氧化性,可以杀菌消毒,还原产物铁离子能够水解生成氢氧化铁胶体,可以吸附悬浮物,故答案为:高于;杀菌消毒、吸附悬浮物;
(3) K2FeO4水解显碱性。A.用水洗涤,K2FeO4水解,错误;B.K2FeO4中铁为+6价,具有强氧化性,能够与亚硫酸氢钠溶液发生氧化还原反应,错误;C.用氢氧化钠溶液洗涤,可以抑制K2FeO4水解,但会引入新杂质,错误;D.先用氢氧化钠溶液洗涤,可以抑制K2FeO4水解,后乙醇洗涤,除去表面的氢氧化钠,且乙醇易挥发,正确;故选D;
(4) 电镀池中镀件金属铝作阳极,金属铝失电子发生氧化反应,Al+7AlCl4-3e-=4Al2Cl7,故答案为:阳;Al+7AlCl4-3e-=4Al2Cl7;
(5) 气态氯化铝的密度为11.92g/L,则气态氯化铝的摩尔质量=11.92g/L×22.4L/mol=267g/mol,分子式为Al2Cl6,故答案为:Al2Cl6;
(6)假设溶液体积为0.1L,则0.1L溶液中含有氢氧化铝的物质的量=![]() =1×10-4mol,则pH=10时,c{[Al(OH)4]-}=
=1×10-4mol,则pH=10时,c{[Al(OH)4]-}= ![]() =1×10-3mol/L,Al(OH)3+H2O
=1×10-3mol/L,Al(OH)3+H2O ![]() [Al(OH)4]- +H+,溶度积= c{[Al(OH)4]-}c(H+)=1×10-3×1×10-10=1×10-13,pH=3时,c(Al3+)=1×10-3mol/L,Al(OH)3
[Al(OH)4]- +H+,溶度积= c{[Al(OH)4]-}c(H+)=1×10-3×1×10-10=1×10-13,pH=3时,c(Al3+)=1×10-3mol/L,Al(OH)3![]() Al3++3OH-,溶度积= c(Al3+) c3(OH-)=1×10-3×(1×10-11)3=1×10-36,则25℃下氢氧化铝的两种溶解方式的溶度积之比为
Al3++3OH-,溶度积= c(Al3+) c3(OH-)=1×10-3×(1×10-11)3=1×10-36,则25℃下氢氧化铝的两种溶解方式的溶度积之比为![]() =1023,故答案为:1023。
=1023,故答案为:1023。