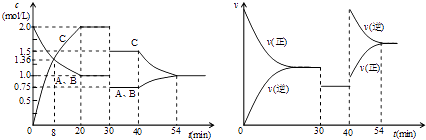题目内容
【题目】氮及其化合物在人们的日常生活、生产和环保事业中属于“明星物质”。回答下列问题:
(1)氨气是农业肥料和化工生产的重要原料,其电子式为____。
(2)叠氮化钠(NaN3)在药物制备、合成影像、化学分析、汽车制造等行业有着广泛的用途,但该物质极易爆炸,且有副毒。可用NaClO溶液对含有叠氮化钠的溶液进行处理,生成一种无污染的气体单质,反应的化学方程式为______________。
(3)“固氮”是农业科学家研究的永恒主题。在某特殊催化剂和光照条件下,N2与水反应可生成NH3。
已知:
(i)4NH3(g)+3O2(g)![]() 2N2(g) +6H2O(g) △H1=-1266 kJ/mol;
2N2(g) +6H2O(g) △H1=-1266 kJ/mol;
(ii)H2O(g)=H2O(l) △H2= -44.0kJ/mol。
则2N2(g) +6H2O(l)![]() 4NH3(g)+3O2(g) △H3=______kJ/mol。
4NH3(g)+3O2(g) △H3=______kJ/mol。
(4)目前“人工固氮”最成功的应用就是工业合成氨:
N2(g) +3H2(g)![]() 2NH3(g) △H=-92.4kJ/mol。将1.00molN2和3.00molH2充入到容积为3L的恒容密闭容器中,发生上述反应。
2NH3(g) △H=-92.4kJ/mol。将1.00molN2和3.00molH2充入到容积为3L的恒容密闭容器中,发生上述反应。

①图甲是测得X、Y 的浓度随时间变化的曲线.其中Y 为_____(写化学式),反应达到平衡时的平均反应速率v(N2) =_________。
②在不同温度和压强下,平衡体系中NH3的体积分数与温度、压强关系如图乙,则压强p1_____p2(填“>”“<”“=”或“不确定”,下同),B、D 两点的平衡常数KB____KD,B 点N2 的转化率=_________(保留3位有效数字)。
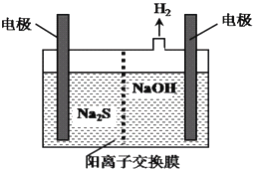
(5)“绿水青山就是金山银山”,利用原电池原理(6NO2 +8NH3=7N2+12H2O)可以处理氮的氧化物和NH3 尾气,装置原理图如图丙:

负极反应式为__________,当有标准状况下4.48 L NO2被处理时,转移电子的物质的量为_____mol。
【答案】  NaClO+2NaN3+ H2O=NaCl +2NaOH +3N2↑ +1 530 H2 0.025 mol· L-1· min-1 < > 82.4% 2NH3 -6e- +6OH-=N2+6H2O 0.8
NaClO+2NaN3+ H2O=NaCl +2NaOH +3N2↑ +1 530 H2 0.025 mol· L-1· min-1 < > 82.4% 2NH3 -6e- +6OH-=N2+6H2O 0.8
【解析】(1)氨气的电子式为![]() 。
。
(2)由题中信息可知,叠氮化钠(NaN3)可与NaClO溶液反应,生成氮气,根据元素的化合价变化规律,该反应的化学方程式为NaClO+2NaN3+ H2O=NaCl +2NaOH +3N2↑。
(3)已知:(i)4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) △H1=-1266kJ/mol;(ii)H2O(g)=H2O(l) △H2=-44.0kJ/mol。根据盖斯定律,由(i)
2N2(g)+6H2O(g) △H1=-1266kJ/mol;(ii)H2O(g)=H2O(l) △H2=-44.0kJ/mol。根据盖斯定律,由(i)![]() - (ii)
- (ii)![]() 可得2N2(g)+6H2O(l)
可得2N2(g)+6H2O(l)![]() 4NH3(g)+3O2(g) △H3=+1 530 kJ/mol。
4NH3(g)+3O2(g) △H3=+1 530 kJ/mol。
(4)①由图甲可知, 从反应开始到达平衡,X、Y的变化量分别为0.50 mol/L和0.75 mol/L,变化量之比为2:3,所以,X为NH3、Y为H2,反应达到平衡时的平均反应速率v(N2)=![]() 0.025 mol L-1min-1。
0.025 mol L-1min-1。
②由合成氨的反应可知,在相同温度下,压强越大,氨的体积分数越大;在相同压强下,温度越高氨的体积分数越小,其平衡常数越小。由图乙可知,在300℃下,平衡体系中NH3的体积分数:B点大于C点。所以,压强p1<p2;B、D两点的平衡常数KB>KD;B点氨的体积分数为70%,设氮气的转化率为x,则氢气和氨气的变化量分别为3x和2x,所以,![]() ,解之得x=
,解之得x=![]() ,所以,N2的转化率
,所以,N2的转化率![]() =82.4%。
=82.4%。
(5)由题意可知,氨气在负极上发生氧化反应生成氮气,其电极反应式为2NH3 -6e- +6OH-=N2+6H2O。当有标准状况下4.48LNO2被处理时,即0.2mol NO2被还原,N的化合价由+4降为0,转移电子的物质的量为0.8mol。

 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案