题目内容
【题目】已知分解反应2N2O5(g)![]() 4NO2(g) + O2(g)的速率方程式v = k·cm(N2O5),k是与温度有关的常数,实验测定340K时的有关数据及根据相关数据做出的图像如下:
4NO2(g) + O2(g)的速率方程式v = k·cm(N2O5),k是与温度有关的常数,实验测定340K时的有关数据及根据相关数据做出的图像如下:
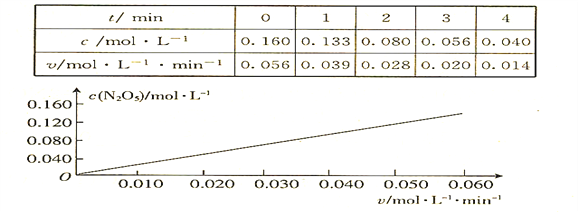
依据图表中的有关信息,判断下列有关叙述中不正确的是
A. 340K时,速率方程式中的m = 1
B. 340K时,速率方程式中的k = 0.350 min-1
C. 340K时,c(N2O5)= 0.100 mol·l-1时,v = 0.035 mol·l-1 ·min-1
D. 340K时,压强增大一倍,逆反应速率不变,正反应速率是原来的2倍
【答案】D
【解析】依据图表中的信息可知,在340K,反应开始时,v = k·0.16m=0.056;第2min, v = k·0.08m=0.028,所以![]() ,所以m=1,k=
,所以m=1,k=![]() ,当c(N2O5)= 0.100 mol·l-1时,代入公式得v = 0.035 mol·l-1 ·min-1。若压强增大一倍,反应混合物中各组分的浓度均增大,所以正反应速率和逆反应速率都要增大。综上所述,只有D不正确。本题选D.
,当c(N2O5)= 0.100 mol·l-1时,代入公式得v = 0.035 mol·l-1 ·min-1。若压强增大一倍,反应混合物中各组分的浓度均增大,所以正反应速率和逆反应速率都要增大。综上所述,只有D不正确。本题选D.

练习册系列答案
相关题目