题目内容
【题目】能源开发、环境保护、资源利用等是当今社会的热门话题。请根据所学化学知识回答下列问题:
(1)汽车上安装催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。
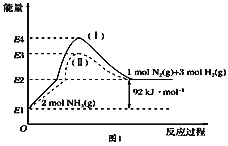
已知:N2(g) + O2(g)=2NO(g) △H=+180.5 kJ · mol-1;
2C(s)+ O2(g)=2CO(g) △H=-221.0 kJ · mol-1;
C(s)+ O2(g)=CO2(g) △H=-393.5 kJ · mol-1;
则尾气转化反应2NO(g) +2CO(g)=N2(g)+2CO2(g)的△H=________________。
(2)汽车尾气分析仪对CO的含量分析是以燃料电池为工作原理,其装置如下图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质中自由移动。

下列说法中正确的是_____________(填字母序号)。
A.负极的电极反应式为:CO + O2-―2e-=CO2
B.工作时电子由电极a通过传感器流向电极b
C.工作时电极b作正极,O2-由电极a通过固体介质向电极b迁移
D.传感器中通过的电流越大,尾气中CO的含量越高
(3)某硝酸厂利用甲醇处理废水。在一定条件下,向废水中加入CH3OH,将HNO3还原成N2。若该反应消耗32 g CH3OH转移6 mol电子,则参加反应的还原剂和氧化剂的物质的量之比为______________。
(4)煤的间接液化是先转化为CO和H2,再在催化剂作用下合成甲醇。若在一定温度下,向1 L密闭容器中加入CO和H2,发生反应CO(g)+2H2(g)![]() CH3OH(g),经10 min反应达到平衡时测得各组分的浓度如下:
CH3OH(g),经10 min反应达到平衡时测得各组分的浓度如下:
物 质 | CO | H2 | CH3OH |
浓度/(mol·L-1) | 1.2 | 1.0 | 0.6 |
①该反应的平衡常数表达式为:K=_____________________。
②该时间内反应速率υ(H2)=_________________。
③平衡时CO的转化率为_________________(保留1位小数)。
【答案】-746.5 kJ · mol-1 A B D 5 : 6 ![]() 0.12 mol/(L·min) 33.3%
0.12 mol/(L·min) 33.3%
【解析】
(1)依据盖斯定律计算热化学方程式;
(2)燃料电池中燃料在负极失电子发生氧化反应,氧气在正极得到电子发生还原反应,电子从负极沿外电路流向正极,注意O2-可以在固体介质中自由移动;
(3)根据消耗甲醇的量和转移电子的物质的量来书写方程式,并确定氧化剂和还原剂的量的比;
(4)列三段式进行分析。
(1)①N2(g)+O2(g)=2NO(g)△H=+180.5kJ · mol-1;
②2C(s)+O2(g)=2CO(g)△H=-221.0kJ · mol-1;
③C(s)+O2(g)=CO2(g)△H=-393.5kJ · mol-1
依据盖斯定律③×2-①-②得到 2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=(-393.5kJ · mol-1)×2-180.5kJ · mol-1-(-221.0kJ · mol-1)=-746.5kJ · mol-1;
(2)由图可知,在负极一氧化碳失电子生成二氧化碳,电池中电解质为氧化钇-氧化钠,正极氧气得电子生成O2-,其中O2-可以在固体介质中自由移动
A.在负极一氧化碳失电子生成二氧化碳,负极的电极反应式为:CO+O2--2e-=CO2 ;故A正确;
B.工作时,电子由负极沿外电路流向正极,电子由电极a通过传感器流向电极b,故B正确;
C.工作时电极b作正极,O2-由电极b通过固体介质向电极a迁移,故C错误;
D.传感器中通过的电流越大,一氧化碳失电子越多,尾气中CO的含量越高,故D正确;
故选A B D;
(3)消耗32g(1mol)CH3OH转移6mol电子,CH3OH中碳元素的化合价为-2价,则反应后碳的化合价为+4,生成CO2,根据化合价升降总数相等、结合原子守恒得:5CH3OH+6HNO3═5CO2↑+3N2↑+13H2O,氧化剂是硝酸,还原剂是甲醇,参加反应的还原剂和氧化剂的物质的量之比是5:6;
(4)①发生反应CO(g)+2H2(g)![]() CH3OH(g),依据平衡常数定义写出为K=
CH3OH(g),依据平衡常数定义写出为K=![]() ;
;
②发生反应达到平衡,物质的浓度已知,可以依据三段式列式计算;
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始量(mol·L-1) 1.8 2.2 0
变化量(mol·L-1) 0.6 1.2 0.6
平衡量(mol·L-1) 1.2 1.0 0.6
υ(H2)=1.2mol·L-1÷10min=0.12 mol/(L·min);
③依据②计算平衡时一氧化碳转化率=![]() ×100%=33.3%。
×100%=33.3%。

 阅读快车系列答案
阅读快车系列答案【题目】甲醇既可用于基本有机原料,又可作为燃料用于替代矿物燃料。
(1)以下是工业上合成甲醇的两个反应:
反应I: CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g) ![]() H1
H1
反应II:CO2(g)+3H2(g)![]() CH3OH(g)+ H2O(g)
CH3OH(g)+ H2O(g) ![]() H2
H2
①上述反应符合“原子经济”原则的是____________(填“Ⅰ”或“Ⅱ”)。
②下表所列数据是反应I在不同温度下的化学平衡常数(K)。
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断反应I为______________热反应(填“吸”或“放”)。
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分发生反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为_______,此时的温度为_______(从表中选择)。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ![]() H1kJ/mol
H1kJ/mol
②2CO(g)+O2(g)=2CO2(g) ![]() H2kJ/mol
H2kJ/mol
③H2O(g)=H2O(l) ![]() H3 kJ/mol
H3 kJ/mol
则反应 CH3OH(l)+ O2(g)= CO(g)+ 2H2O(l) ![]() H=________kJ/mol
H=________kJ/mol
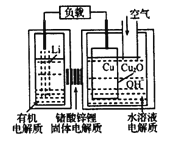
(3)现以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含有Cr2O72)时,实验室利用如图装置模拟该法:
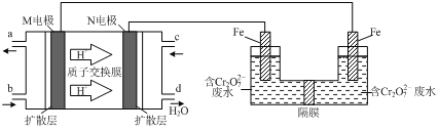
①N电极的电极反应式为____________。
②请完成电解池中Cr2O72-转化为Cr3+的离子反应方程式:
Cr2O72-+_______Fe2+ +________ [___]═ ________Cr3++_______Fe3++_________[___]