题目内容
【题目】元素周期表短周期中六种元素的原子序数与主要化合价的关系如图:
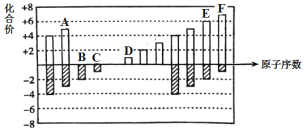
(1)元素F在周期表中的位置是 ______。
(2)元素C、D、E原子半径由大到小的顺序是 ______(填元素符号)。
(3)A、B、C的单质与氢气反应的剧烈程度由强到弱的顺序_____(用单质的化学式表示)。
(4)应用元素周期律和元素周期表的知识,写出D和E所形成的化合物的化学式______、__(写2种)。
(5)根据氯、溴、碘单质间的置换反应,判断F的单质和E的最简单氢化物之间能否发生反应 _____(填“能”或“不能”), 若能则写出反应的化学方程式 ______。
(6)一定温度下,在体积恒定的密闭容器中发生反应:2AB(g)+B2(g) ![]() 2AB2(g)。可以作为达到平衡状态的标志是 ______。
2AB2(g)。可以作为达到平衡状态的标志是 ______。
A. 单位时间内生成nmolB2的同时生成2nmolAB B. 2 ν正(B2)=ν逆(AB2)
C. 混合气体的颜色不再改变(AB2为有色气体) D. 混合气体的密度不变
【答案】第3周期ⅦA族 Na>S>F F2>O2>N2 Na2S Na2S2 能 Cl2+H2S=S+2HCl BC
【解析】
有六种元素的原子序数与主要化合价的关系图可知:A,B,C,D,E,F的元素符号分别为:N,O,F,Na,S,Cl。
(1)元素F是Cl,在周期表中的位置是第3周期ⅦA族;
(2)同周期原子半径逐渐增大,同主族原子半径从上到下逐渐增大,故元素C、D、E原子半径由大到小的顺序是Na>S>F ; (3)同周期随原子序数的增加非金属性逐渐增强,非金属性越强与氢气反应的剧烈程度越强,故顺序为F2>O2>N2;
(4)钠的化合价是+1价,硫在化合物中的价态有-2,-1价,故形成的化合物为Na2S,Na2S2
(5)氯的非金属性比硫强,所以能反应,反应的化学方程式Cl2+H2S=S+2HCl;
(6)A. 单位时间内生成nmolB2的同时生成2nmolAB,是同一个方向,故错误;
B. 2 ν正(B2)=ν逆(AB2),可以得出ν正(B2)=ν逆(B2),故正确;
C. 混合气体的颜色不再改变,说明NO2的浓度不变,处于平衡状态;
D. 混合气体的密度不变不能作为平衡状态的依据,因为反应物生成物都是气体,气体质量不变,体积不变,故密度不变,故错误。

 名校课堂系列答案
名校课堂系列答案