题目内容
【题目】已知Ka(CH3COOH)=1.7×10-5,Kb(NH3·H2O)=1.7×10-5。常温下,用0.01mol·L-1氨水滴定20mL浓度均为0.01mol·L-1的HCl和CH3COOH混合溶液,相对导电能力随加入氨水体积变化曲线如图所示。下列叙述错误的是( )
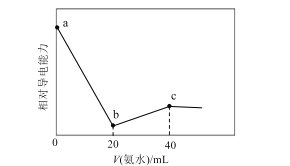
A.a点的混合溶液中c(CH3COO-)约为1.7×10-5mol·L-1
B.b点的混合溶液中:c(CH3COOH)>c(NH4+)
C.c点的混合溶液中:c(NH4+)+c(NH3·H2O)=c(Cl-)+c(CH3COO-)+c(CH3COOH)
D.混合溶液pH=7时,加入氨水体积大于40mL
【答案】B
【解析】
a点为浓度均为0.01mol/L的盐酸和醋酸(1:1)混合溶液,b点溶质为等浓度氯化铵和醋酸,c点溶质为等浓度氯化铵和醋酸铵,根据醋酸的电离平衡常数表达式,电荷守恒,物料守恒分析。
A.a点为浓度均为0.01mol/L的盐酸和醋酸(1:1)混合溶液,盐酸全部电离,醋酸部分电离,根据醋酸的电离平衡表达式: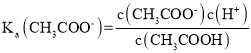 ;可以得到
;可以得到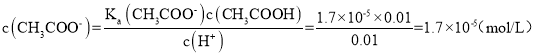 ,故A正确;
,故A正确;
B.Ka(CH3COOH)=1.7×10-5, ![]() ,Ka(CH3COOH)>Kh(NH4+),醋酸电离程度大于NH4+水解程度,则c(NH4+)>c(CH3COOH),故B错误;
,Ka(CH3COOH)>Kh(NH4+),醋酸电离程度大于NH4+水解程度,则c(NH4+)>c(CH3COOH),故B错误;
C.点溶液中恰好生成等量的NH4Cl和CH3COONH4,根据物料守恒:2c(Cl)=c(NH4+)+c(NH3H2O),2c(CH3COOH)+2c(CH3COO)=c(NH4+)+c(NH3H2O),c(Cl)=c(CH3COO)+c(CH3COOH),所以有c(NH4+)+c(NH3H2O)=c(Cl)+c(CH3COO)+c(CH3COOH),故C正确;
D.c点溶质为等浓度氯化铵和醋酸铵,Ka(CH3COOH)=1.7×10-5,Kb(NH3·H2O)=1.7×10-5,即醋酸的酸性和氨水的碱性相当,在醋酸氨溶液中,铵根离子和醋酸根离子的水解程度相近,溶液呈中性,氯化铵属于强酸弱碱盐,显酸性,要让混合溶液pH=7即中性,加入氨水体积需大于40mL,故D正确;
答案选B。

 快捷英语周周练系列答案
快捷英语周周练系列答案【题目】某小组同学通过实验研究FeCl3溶液与Cu发生的氧化还原反应,实验记录如下表所示,下列说法错误的是( )
序号 | Ⅰ | Ⅱ | Ⅲ |
实验步骤 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
实验现象 | 铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象 | 铜有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀 | 铜有剩余,溶液黄色褪去,变成蓝色加入蒸馏水后无白色沉淀 |
A.实验Ⅰ、Ⅱ、Ⅲ中均涉及Fe3+被还原
B.对比实验Ⅰ、Ⅱ、Ⅲ说明白色沉淀的产生可能与铜粉的量及溶液中阴离子种类有关
C.实验Ⅱ、Ⅲ中加水后c(Cu2+)相同
D.向实验Ⅲ反应后的溶液中加入饱和NaCl溶液可能出现白色沉淀
【题目】氮的化合物在工业生产和生活中都有重要的应用,运用化学原理研究氮的单质及其化合物具有重要意义。
Ⅰ.一定条件下(T ℃、1.01×105 Pa),可以用Cl2(g)和NH3(g)制得NH2Cl(g),同时得到HCl(g)。已知部分化学键的键能如下表:
化学键 | N-H | Cl-Cl | N-Cl | H-Cl |
键能/kJ/mol | 391.3 | 243.0 | 191.2 | 431.8 |
写出该反应的热化学方程式:___________________________________________。
Ⅱ.亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO与Cl2在一定条件下合成:2NO(g)+Cl2(g) ![]() 2NOCl(g) ΔH<0。保持恒温恒容条件,将物质的量之和为3 mol的NO和Cl2以不同的氮氯比
2NOCl(g) ΔH<0。保持恒温恒容条件,将物质的量之和为3 mol的NO和Cl2以不同的氮氯比![]() 进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:
进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:
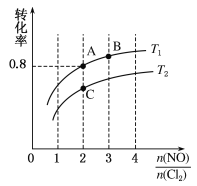
(1)图中T1、T2的关系为T1________T2(填“>”“<”或“=”)。
(2)图中纵坐标为物质________的转化率,理由为_________________________________。
(3)图中A、B、C三点对应的NOCl体积分数最大的是________(填“A”“B”或“C”)。
(4)若容器容积为1 L,经过10min到达A点,该时间段内化学反应速率υ(NO)=_________。B点的平衡常数为________。
(5)若在温度为T1,容积为1 L的容器中,充入0.5mol NO、1mol Cl2、2mol NOCl,υ(正)_____υ(逆) (填“<”“>”或“=”),理由为________________________________