题目内容
【题目】密闭容器中发生反应:2X(g)+Y(s)![]() 2Z(g) ΔH<0,达到平衡时,下列说法正确的( )
2Z(g) ΔH<0,达到平衡时,下列说法正确的( )
A.减小容器体积,平衡正向移动B.再加入Z,达平衡时Z的体积分数增大
C.再加入X,X的转化率减小D.降低温度,Y的转化率增大
【答案】D
【解析】
A.减小容器体积,即增大体系的压强,由于该反应是反应前后气体体积相等的反应,所以化学平衡不移动,A错误;
B.再加入Z,反应逆向进行,由于增大Z的浓度,相当于增大体系的压强,化学平衡不发生移动,所以达平衡时Z的体积分数不变,B错误;
C.再加入X,使体系的压强增大,增大压强,化学平衡不发生移动,所以平衡时X的转化率不变,C错误;
D.降低温度,化学平衡向放热的正反应方向移动,使Y的转化率增大,D正确;
故合理选项是D。

 阅读快车系列答案
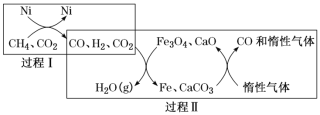
阅读快车系列答案【题目】氮的化合物在工业生产和生活中都有重要的应用,运用化学原理研究氮的单质及其化合物具有重要意义。
Ⅰ.一定条件下(T ℃、1.01×105 Pa),可以用Cl2(g)和NH3(g)制得NH2Cl(g),同时得到HCl(g)。已知部分化学键的键能如下表:
化学键 | N-H | Cl-Cl | N-Cl | H-Cl |
键能/kJ/mol | 391.3 | 243.0 | 191.2 | 431.8 |
写出该反应的热化学方程式:___________________________________________。
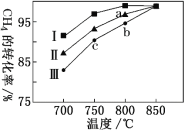
Ⅱ.亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO与Cl2在一定条件下合成:2NO(g)+Cl2(g) ![]() 2NOCl(g) ΔH<0。保持恒温恒容条件,将物质的量之和为3 mol的NO和Cl2以不同的氮氯比
2NOCl(g) ΔH<0。保持恒温恒容条件,将物质的量之和为3 mol的NO和Cl2以不同的氮氯比![]() 进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:
进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:
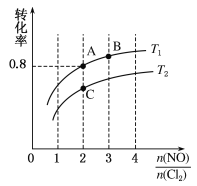
(1)图中T1、T2的关系为T1________T2(填“>”“<”或“=”)。
(2)图中纵坐标为物质________的转化率,理由为_________________________________。
(3)图中A、B、C三点对应的NOCl体积分数最大的是________(填“A”“B”或“C”)。
(4)若容器容积为1 L,经过10min到达A点,该时间段内化学反应速率υ(NO)=_________。B点的平衡常数为________。
(5)若在温度为T1,容积为1 L的容器中,充入0.5mol NO、1mol Cl2、2mol NOCl,υ(正)_____υ(逆) (填“<”“>”或“=”),理由为________________________________
【题目】氧、硫形成的化合物种类繁多,日常生活中应用广泛。如硫代硫酸钠(Na2S2O3)可作为照相业的定影剂,反应的化学方程式如下:AgBr+2Na2S2O3===Na3[Ag(S2O3)2]+NaBr。回答下列问题:
(1)基态S的价电子排布图为____________。
(2)下列关于物质结构与性质的说法,正确的是________。
A.玻尔原子结构模型能够成功地解释各种原子光谱
B.Br、S、O三种元素的电负性顺序为 O>Br>S
C.Na的第一电离能小于 Mg,但其第二电离能却远大于 Mg
D.水分子间存在氢键,故H2O的熔沸点及稳定性均大于H2S
(3)依据VSEPR理论推测![]() 的空间构型为______,中心原子S的杂化方式为________,[Ag(S2O3)2]3-中存在的化学键有________(填字母)。
的空间构型为______,中心原子S的杂化方式为________,[Ag(S2O3)2]3-中存在的化学键有________(填字母)。
A.离子键 B.极性键 C.非极性键 D.金属键 E.配位键
(4)第一电子亲和能(E1)是指元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量(单位为kJ·mol-1),电子亲和能越大,该元素原子越易得电子。已知第三周期部分元素第一电子亲和能如下表:
元素 | Al | Si | P | S | Cl |
E1/(kJ·mol-1) | 42.5 | 134 | 72.0 | 200 | 349 |
表中元素的E1自左而右呈增大趋势,试分析P元素呈现异常的原因___________。
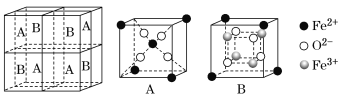
(5)某种离子型铁的氧化物晶胞如图所示,它由A、B组成。则该氧化物的化学式为_____,已知该晶体的晶胞参数为a nm,阿伏加德罗常数的值为NA,则密度ρ为______g·cm-3(用含a和NA 的代数式表示)。
【题目】(1)葡萄酒中SO2最大使用量为0.25g·L-1,取300.00mL葡萄酒,通过适当的方法使所含SO2全部逸出并用H2O2将其全部氧化为H2SO4,然后用0.0900mol·L-1NaOH标准溶液进行滴定。
①滴定前排气泡时,应选择如图中的___(填序号)

②若用50mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积___(填序号)。
①=10mL ②=40mL ③<10 mL ④>40 mL。
③上述滴定实验中若滴定终点时溶液的pH=8.8,则选择的指示剂为______,选择该指示剂时如何判断反应到达滴定终点:______。
④滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2含量为___g·L-1;滴定终点读数时俯视刻度线,则测量结果比实际值______(填“偏高”、“偏低”或“无影响”)。
(2)某学生用0.100molL-1的KOH标准溶液滴定未知浓度的盐酸,其操作为:
A.移取20mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴处充满溶液;
D.取标准KOH溶液注入碱式滴定管至刻度“0”以上2~3cm 处;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管下面,用标准KOH溶液滴定至终点并记下刻度。
实验编号 | KOH溶液的浓度(mol/L) | 滴定完成时,KOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
①正确操作步骤的顺序是(用序号字母填写)_________。
②根据上述数据,可计算出该盐酸的浓度约为_______(保留两位有效数字)。