题目内容
15.下列事实不能用来判断金属性强弱的是( )| A. | 金属间在溶液中发生置换反应 | |
| B. | 1 mol金属单质在反应中失去电子的多少 | |
| C. | 金属元素的最高价氧化物的水化物的碱性强弱 | |
| D. | 金属单质与水或酸置换出氢气的难易 |
分析 A.活泼金属能将不活泼金属从其盐中置换出来;
B.金属性强弱与失去电子难易程度有关,与失去电子数目多少无关;
C.金属元素的最高价氧化物对应的水化物的碱性越强,则金属性越强;
D.金属元素的单质与水或酸反应置换出氢气越容易,金属单质越活泼,则金属性越强.
解答 解:A.活泼金属能将不活泼金属从其盐中置换出来,通过金属间发生的置换反应能用于判断金属性强弱,故A正确;
B.1mol金属单质失电子的多少由原子结构决定,与失电子能力强弱无关,如1molNa失去电子比较1molMg失去电子少,但金属性Na>Mg,故B错误;
C.金属元素的金属性越强,其最高价氧化物对应的水化物的碱性越强,故C正确;
D.金属元素的金属性越强,单质越活泼,单质与水或酸反应置换越容易置换出氢气,故D正确.
故选B.
点评 本题考查金属性强弱比较,注意对元素周期律的理解掌握,侧重对基础知识的巩固,易错选项是B,注意不能根据失电子多少判断金属性,要根据失电子难易程度判断金属性.

练习册系列答案
相关题目
4.按系统命名法,下列名称不正确的是( )
| A. | 2一甲基丁烷 | B. | 2一甲基丙烷 | C. | 2,2一二甲基丙烷 | D. | 2一乙基丙烷 |
 乳酸亚铁晶体([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是常用的补铁剂.乳酸亚铁可由乳酸与碳酸亚铁(易被空气中氧气氧化)反应制得:2CH3CH(OH)COOH+FeCO3→[CH3CH(OH)COO]2Fe+CO2↑+H2O.
乳酸亚铁晶体([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是常用的补铁剂.乳酸亚铁可由乳酸与碳酸亚铁(易被空气中氧气氧化)反应制得:2CH3CH(OH)COOH+FeCO3→[CH3CH(OH)COO]2Fe+CO2↑+H2O. ;
; ;
; .
.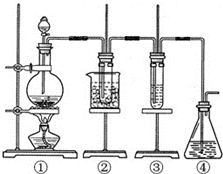 某学习小组设计了如图所示的实验方案来制取次氯酸钠和探究氯水的性质.图中:
某学习小组设计了如图所示的实验方案来制取次氯酸钠和探究氯水的性质.图中: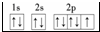 ;E3+的离子符号为Fe3+.
;E3+的离子符号为Fe3+. ;
; ;
;
 .
.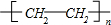 (或CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH).
(或CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH).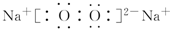 .
.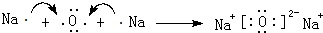 .羰基硫(COS)分子结构与AB2分子结构相似,所有原子的最外层都满足8电子结构.用电子式表示羰基硫分子
.羰基硫(COS)分子结构与AB2分子结构相似,所有原子的最外层都满足8电子结构.用电子式表示羰基硫分子 .
.