题目内容
5.A、B、C、D、E都是短周期元素,原子半径D>C>A>E>B,其中A、B处在同一周期,A、C处在同一主族.C原子核内质子数等于A、B原子核内质子数之和,C原子最外层上的电子数是D原子最外层电子数的4倍,且D为金属.试回答:(1)C在元素周期表的位置:第三周期IVA族.
(2)在五种元素中除D外都是非金属元素,这四种非金属形成的最简单的液态或气态氢化物的稳定性由大到小的顺序是(用具体的分子式表示)H2O>NH3>CH4>SiH4.
(3)E的氢化物的熔沸点比其同主族元素形成氢化物的熔沸点要高,原因是NH3分子间存在氢键,使熔沸点升高.
(4)A与B形成的三原子分子的结构式是O=C=O,B与D形成的原子个数比为1:1的化合物的电子式是
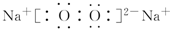 .
.(5)E的一种氢化物叫肼,其分子中E原子与氢原子个数比为1:2.肼-空气燃料电池是一种环保碱性燃料电池,其电解质溶液是20%-30%的KOH溶液.该燃料电池的正极的电极反应式是O2+2H2O+4e-=4OH-.
(6)用电子式表示D2B的形成过程
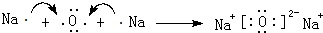 .羰基硫(COS)分子结构与AB2分子结构相似,所有原子的最外层都满足8电子结构.用电子式表示羰基硫分子
.羰基硫(COS)分子结构与AB2分子结构相似,所有原子的最外层都满足8电子结构.用电子式表示羰基硫分子 .
.
分析 A、B、C、D、E都是短周期元素,原子半径D>C>A>E>B,其中A、B处在同一周期,A、C处在同一主族,四种元素在周期表中的大致相对位置为: ,A、C处在同一主族,二者质子数相差8,C原子核内质子数等于A、B原子核内质子数之和,故B的质子数为8,则B为O元素;C原子最外层上的电子数是D原子最外层电子数的4倍,故C最外层电子数为4,D的最外层电子数为1,可推知A为碳元素,C为Si元素,D为Na元素,E的原子半径介于碳、氧之间,故E为N元素,据此解答.
,A、C处在同一主族,二者质子数相差8,C原子核内质子数等于A、B原子核内质子数之和,故B的质子数为8,则B为O元素;C原子最外层上的电子数是D原子最外层电子数的4倍,故C最外层电子数为4,D的最外层电子数为1,可推知A为碳元素,C为Si元素,D为Na元素,E的原子半径介于碳、氧之间,故E为N元素,据此解答.
解答 解:A、B、C、D、E都是短周期元素,原子半径D>C>A>E>B,其中A、B处在同一周期,A、C处在同一主族,四种元素在周期表中的大致相对位置为: ,A、C处在同一主族,二者质子数相差8,C原子核内质子数等于A、B原子核内质子数之和,故B的质子数为8,则B为O元素;C原子最外层上的电子数是D原子最外层电子数的4倍,故C最外层电子数为4,D的最外层电子数为1,可推知A为碳元素,C为Si元素,D为Na元素,E的原子半径介于碳、氧之间,故E为N元素.
,A、C处在同一主族,二者质子数相差8,C原子核内质子数等于A、B原子核内质子数之和,故B的质子数为8,则B为O元素;C原子最外层上的电子数是D原子最外层电子数的4倍,故C最外层电子数为4,D的最外层电子数为1,可推知A为碳元素,C为Si元素,D为Na元素,E的原子半径介于碳、氧之间,故E为N元素.
(1)C为Si元素,处于周期表中第三周期IVA族,故答案为:第三周期IVA族;
(2)氢化物稳定性与元素非金属性一致,由于非金属性O>N>C>Si,故氢化物稳定性:H2O>NH3>CH4>SiH4,故答案为:H2O>NH3>CH4>SiH4;
(3)E的氢化物为NH3,NH3分子间存在氢键,熔沸点比其同主族元素形成氢化物的熔沸点要高,
故答案为:NH3分子间存在氢键,使熔沸点升高;
(4)A与B形成的三原子分子为CO2,结构式是 O=C=O,B与D形成的原子个数比为1:1的化合物为Na2O2,电子式是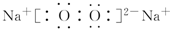 ,故答案为:O=C=O;
,故答案为:O=C=O;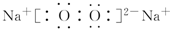 ;
;
(5)E的一种氢化物叫肼,其分子中E原子与氢原子个数比为1:2,则肼的分子式为N2H4,肼-空气燃料电池是一种环保碱性燃料电池,其电解质溶液是20%-30%的KOH溶液,原电池正极发生还原反应,氧气在正极获得电子,碱性条件下生成氢氧根离子,该燃料电池的正极的电极反应式是:O2+2H2O+4e-=4OH-,
故答案为:O2+2H2O+4e-=4OH-;
(6)用电子式表示Na2O的形成过程为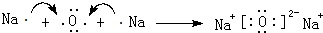 .羰基硫(COS)分子结构与CO2分子结构相似,所有原子的最外层都满足8电子结构,用电子式表示羰基硫分子 为:
.羰基硫(COS)分子结构与CO2分子结构相似,所有原子的最外层都满足8电子结构,用电子式表示羰基硫分子 为: ,
,
故答案为: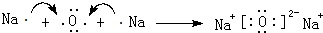 ;
; .
.
点评 本题考查元素位置结构性质的关系,侧重对化学用语及元素周期律的考查,题目难度中等,关键是正确推断元素的种类,注意根据原子位置关系及半径大小找出其在周期表中的相对位置.

 阅读快车系列答案
阅读快车系列答案| A. | 金属间在溶液中发生置换反应 | |
| B. | 1 mol金属单质在反应中失去电子的多少 | |
| C. | 金属元素的最高价氧化物的水化物的碱性强弱 | |
| D. | 金属单质与水或酸置换出氢气的难易 |
| A. | 1s22s22p63s23p64s2 | B. | 1s22s22p63s23p3 | ||
| C. | 1s22s22p63s23p2 | D. | 1s22s22p4 |

| A. | ①②③⑤⑥⑦ | B. | ②③④⑥⑧ | C. | ①②③④⑥ | D. | ③⑤⑥⑦⑧ |
| A. | CHCl3 | B. | CH(CH3) 3 | C. | CCl4 | D. | CH3CH3 |
 在某一容积为2L的密闭容器内,加入0.8mol的H2和0.6mol的I2,在一定的条件下发生如下反应:H2(g)+I2(g)?2HI(g)△H<0,反应中各物质的浓度随时间变化情况如图1:
在某一容积为2L的密闭容器内,加入0.8mol的H2和0.6mol的I2,在一定的条件下发生如下反应:H2(g)+I2(g)?2HI(g)△H<0,反应中各物质的浓度随时间变化情况如图1: