题目内容
5. 乳酸亚铁晶体([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是常用的补铁剂.乳酸亚铁可由乳酸与碳酸亚铁(易被空气中氧气氧化)反应制得:2CH3CH(OH)COOH+FeCO3→[CH3CH(OH)COO]2Fe+CO2↑+H2O.
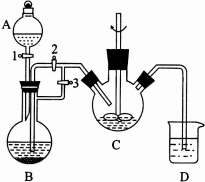
乳酸亚铁晶体([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是常用的补铁剂.乳酸亚铁可由乳酸与碳酸亚铁(易被空气中氧气氧化)反应制得:2CH3CH(OH)COOH+FeCO3→[CH3CH(OH)COO]2Fe+CO2↑+H2O.某兴趣小组用FeCl2(用铁粉与盐酸反应制得)和NH4HCO3制备FeCO3的装置示意图如图所示.回答下列问题:
(1)A装置的名称是分液漏斗.
(2)将生成的FeCl2溶液压入C装置的操作是关闭活塞3,打开活塞2,该装置中涉及的主要反应的离子方程式为Fe2++2HCO3-=FeCO3↓+CO2↑+H2O.
(3)将制得的FeCO3加入到乳酸溶液中,再加入少量铁粉,75℃下搅拌使之充分反应,然后向其中加入适量的乳酸,除去铁粉.其中加入少量铁粉的作用是防止Fe2+离子被氧化.
(4)从上述(3)所得溶液中获得乳酸亚铁晶体的方法是:冷却结晶、过滤、洗涤、干燥.
(5)该兴趣小组用KMnO4测定产品中亚铁含量进而计算乳酸亚铁晶体的质量分数,发现产品的质量分数总是大于100%,其原因可能是乳酸根离子中含有羟基,被酸性高锰酸钾溶液氧化.经查阅文献后,该兴趣小组改用铈(Ce)量法测定产品中Fe2+的含量.取2.880g产品配成100mL溶液,每次取20.00mL,进行必要处理,用0.1000mol/L Ce(SO4)2标准溶液滴定至终点,平均消耗Ce(SO4)2 19.7mL.滴定反应为:Ce4++Fe2+=Ce3++Fe3+,则产品中乳酸亚铁晶体的质量分数为98.5%.
分析 (1)由仪器A的结构特征,可知A为分液漏斗;
(2)利用生成氢气,使B装置中气压增大,将B装置中的氯化亚铁溶液压入C中;C装置中FeCl2和NH4HCO3发生反应:FeCl2+2NH4HCO3=FeCO3↓+2NH4Cl+CO2↑+H2O;
(3)实验目的是制备乳酸亚铁晶体,加入Fe粉,防止Fe2+离子被氧化,过量的铁粉用乳酸除去,Fe被充分利用;
(4)从溶液中获得晶体,应经过冷却结晶、过滤、洗涤、干燥等操作;
(5)乳酸根中含有羟基,可以被酸性高锰酸钾溶液氧化,导致消耗高锰酸钾的增大,而计算中按亚铁离子被氧化,故计算所得乳酸亚铁的质量偏大;
根据离子方程式计算20mL溶液中n(Fe2+),进而计算100mL含有n(Fe2+),再根据m=nM计算乳酸亚铁晶体的质量,进而计算产品中乳酸亚铁晶体的质量分数.
解答 解:(1)由仪器A的结构特征,可知A为分液漏斗,故答案为:分液漏斗;
(2)利用生成氢气,使B装置中气压增大,将B装置中的氯化亚铁溶液压入C中,具体操作为:关闭活塞3,打开活塞2;
C装置中FeCl2和NH4HCO3发生反应:FeCl2+2NH4HCO3=FeCO3↓+2NH4Cl+CO2↑+H2O,反应离子方程式为:Fe2++2HCO3-=FeCO3↓+CO2↑+H2O,
故答案为:关闭活塞3,打开活塞2;Fe2++2HCO3-=FeCO3↓+CO2↑+H2O;
(3)Fe2+离子易被氧化为Fe3+离子,实验目的是制备乳酸亚铁晶体,加入Fe粉,防止Fe2+离子被氧化,过量的铁粉可以充分利用,得到乳酸亚铁,应用乳酸除去,
故答案为:乳酸;防止Fe2+离子被氧化;
(4)在75℃下搅拌使之充分反应制得乳酸亚铁,从热溶液中获得乳酸亚铁晶体,应经过冷却结晶、过滤、洗涤、干燥等操作,
故答案为:冷却结晶、过滤;
(5)乳酸根中含有羟基,可以被酸性高锰酸钾溶液氧化,导致消耗高锰酸钾的增大,而计算中按亚铁离子被氧化,故计算所得乳酸亚铁的质量偏大,产品中乳酸亚铁的质量分数会大于100%;
由:Ce4++Fe2+=Ce3++Fe3+,可知20mL溶液中n(Fe2+)=n(Ce4+)=0.1000mol/L×0.0197L=0.00197mol,
故100mL含有n(Fe2+)=0.00197mol×$\frac{100mL}{20mL}$=0.00985mol,故产品中乳酸亚铁晶体的质量分数为$\frac{0.00985mol×288g/mol}{2.88g}$×100%=98.5%,
故答案为:乳酸根离子中含有羟基,被酸性高锰酸钾溶液氧化;98.5%.
点评 本题考查实验制备方案,涉及化学仪器识别、对操作的分析评价、物质分离提纯、氧化还原反应滴定应用等,明确原理是解题关键,是对学生综合能力的考查,难度中等.

 名校通行证有效作业系列答案
名校通行证有效作业系列答案| A. | 中和等体积、等物质的量浓度盐酸和醋酸溶液,盐酸所需NaOH溶液多于醋酸 | |
| B. | 常温下,20 LpH=12的Na2CO3溶液中含有的OH-离子数为0.2NA | |
| C. | 向0.1 mol/LCH3COOH溶液中加入少量CH3COONa固 体,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ 增大 | |
| D. | 一定温度下,10mL 0.50mol•L-1NH4Cl溶液与20mL 0.25mol•L-1NH4C1溶液含NH4+物质的量相同 |
| A. | 使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl- | |
| B. | $\frac{{K}_{w}}{c({H}^{+})}$=1×10-13mol•L-1的溶液中:NH4+、Ca2+、Cl-、NO3- | |
| C. | 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42- | |
| D. | 水电离的c(H+)=1×10-13mol•L-1的溶液中:K+、Na+、AlO2-、CO32- |
| A. | 金属间在溶液中发生置换反应 | |
| B. | 1 mol金属单质在反应中失去电子的多少 | |
| C. | 金属元素的最高价氧化物的水化物的碱性强弱 | |
| D. | 金属单质与水或酸置换出氢气的难易 |