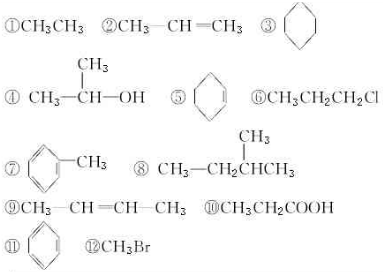
题目内容
10.下列关于元素周期表的叙述,正确的是( )| A. | 周期表是按各元素的相对原子质量递增的顺序从左到右排列的 | |
| B. | 每一周期的元素都是从碱金属开始,以稀有气体结束 | |
| C. | 最外层电子数为2的元素都位于第ⅡA族 | |
| D. | 在已经发现的元素中,金属元素种类比非金属元素多 |
分析 A、周期表按照原子序数的递增及原子结构的周期性变化排列;
B、第一周期不含碱金属元素;
C、He子最外层电子数为2的元素不是处于周期表ⅡA族;
D、在已经发现的一百余种元素中,金属元素的种类远比非金属元素的种类多.
解答 解:A、周期表按照原子序数的递增及原子结构的周期性变化排列,与元素的相对原子质量无关,故A错误;
B、第一周期不含碱金属元素,除第一周期外的每一周期的元素都是从碱金属开始,以稀有气体结束,故B错误;
C、He子最外层电子数为2的元素不是处于周期表ⅡA族,故C错误;
D.一百余种元素中,非金属元素有22种,则金属元素的种类远比非金属元素的种类多,故D正确;
故选D.
点评 本题考查元素周期表的结构及应用,为高频考点,把握元素位置、性质的关系为解答的关键,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
5.下列关于ⅡA族元素的说法中,不正确的是( )
| A. | 元素的主要化合价都是+2价 | |
| B. | 元素的单质都呈银白色 | |
| C. | 有的元素的单质可在自然界中稳定存在 | |
| D. | 其中包括被誉为“国防金属”的元素 |
15.要检验某溴乙烷中的溴元素,正确的实验方法是( )
| A. | 加入氯水振荡,观察水层是否有棕红色溴出现 | |
| B. | 滴入AgNO3溶液,再加入稀硝酸呈酸性,观察有无浅黄色沉淀生成 | |
| C. | 加入NaOH溶液共热,然后加入稀硝酸呈酸性,再滴入AgNO3溶液,观察有无浅黄色沉淀生成 | |
| D. | 加入NaOH溶液共热,冷却后加入AgNO3溶液,观察有无浅黄色沉淀生成 |
2.下列关于物质分类的说法正确的是( )
| A. | 根据是否具有丁达尔现象把分散系分为溶液、胶体、浊液 | |
| B. | 根据在水溶液里或熔化状态下是否导电把物质分为电解质、非电解质 | |
| C. | 凡是含有碳元素的物质为有机物,不含碳元素的物质为无机物 | |
| D. | 根据密度大小把金属分为轻金属和重金属 |
20. 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
(1)常温下5% H2O2在FeCl3溶液的催化作用下发生反应的化学方程式为2H2O2$\frac{\underline{催化剂}}{△}$2H2O↑+O2↑.
(2)实验①和②的目的是探究浓度对反应速率的影响.实验时由于没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进是向反应物中加入等量同种催化剂(或将盛有反应物的试管放入同一热水浴中).
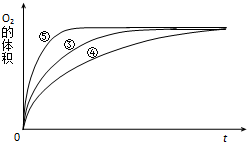
(3)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图.分析图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol•L-1FeCl3溶液 |
(2)实验①和②的目的是探究浓度对反应速率的影响.实验时由于没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进是向反应物中加入等量同种催化剂(或将盛有反应物的试管放入同一热水浴中).
(3)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图.分析图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
 +H2O$\stackrel{NaOH}{→}$
+H2O$\stackrel{NaOH}{→}$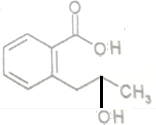 .
.
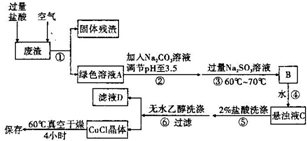 通常情况下,CuCI为白色粉末,微溶于水,不溶于乙醇,常用作有机合成的催化剂,并用于颜料、防腐等工业.CuCI露置于空气中较易被氧化为绿色的高价铜盐,见光易分解,变成褐色,受潮易变成蓝到棕色.有机硅装置在单体合成的生产过程中,副产高沸物、共沸物、硅渣浆液.其中硅渣浆液中含有Si、Cu及有机硅单体等物质,硅渣浆液经过处理后可得到富含硅、铜、碳的废渣.如图是从废渣中制取CuCI的一种工艺流程图.
通常情况下,CuCI为白色粉末,微溶于水,不溶于乙醇,常用作有机合成的催化剂,并用于颜料、防腐等工业.CuCI露置于空气中较易被氧化为绿色的高价铜盐,见光易分解,变成褐色,受潮易变成蓝到棕色.有机硅装置在单体合成的生产过程中,副产高沸物、共沸物、硅渣浆液.其中硅渣浆液中含有Si、Cu及有机硅单体等物质,硅渣浆液经过处理后可得到富含硅、铜、碳的废渣.如图是从废渣中制取CuCI的一种工艺流程图.