题目内容
17.在某条件下,Zn与稀硝酸反应时,其物质的量之比为2:5,则此时硝酸的还原产物是( )| A. | NO2 | B. | NO | C. | N2 | D. | NH4NO3 |
分析 Zn与稀硝酸反应时,其物质的量之比为2:5,其中一部分作酸生成Zn(NO3)2,一部分作氧化剂,根据化学式知,起酸作用的硝酸与锌的物质的量之比为2:1,所以作氧化剂的硝酸与Zn的物质的量之比为1:2,根据转移电子相等确定硝酸还原产物.
解答 解:Zn与稀硝酸反应时,其物质的量之比为2:5,其中一部分作酸生成Zn(NO3)2,一部分作氧化剂,根据化学式知,起酸作用的硝酸与锌的物质的量之比为2:1,所以作氧化剂的硝酸与Zn的物质的量之比为1:2,设硝酸还原产物的化合价为x,
根据转移电子相等得2×(2-0)=1×(5-x),x=+1,
A.二氧化氮中N元素化合价为+4价,不符合条件,故A错误;
B.NO中N元素化合价为+2价,不符合条件,故B错误;
C.氮气中N元素化合价为0价,不符合条件,故C错误;
D.硝酸铵中N元素平均化合价=$\frac{+5-3}{2}$=+1,故D正确;
故选D.
点评 本题以锌和硝酸的反应为载体考查氧化还原反应计算,侧重考查分析计算能力,利用转移电子守恒进行计算,易错选项是D,注意D中可以采用平均化合价判断.

练习册系列答案
相关题目
16.下列关于化学电源的有关说法中,正确的是( )
| A. | 锌锰干电池中石墨棒作负极 | |
| B. | 氢氧燃料电池工作时,氢气在负极发生还原反应 | |
| C. | 铅蓄电池放电时,两极质量均增加 | |
| D. | 燃料电池的能量转化率可达100% |
5.下列关于ⅡA族元素的说法中,不正确的是( )
| A. | 元素的主要化合价都是+2价 | |
| B. | 元素的单质都呈银白色 | |
| C. | 有的元素的单质可在自然界中稳定存在 | |
| D. | 其中包括被誉为“国防金属”的元素 |
12.通常用来衡量一个国家石油化工发展水平的标志是( )
| A. | 石油的产量 | B. | 乙烯的产量 | C. | 硫酸的产量 | D. | 合成纤维的产量 |
2.下列关于物质分类的说法正确的是( )
| A. | 根据是否具有丁达尔现象把分散系分为溶液、胶体、浊液 | |
| B. | 根据在水溶液里或熔化状态下是否导电把物质分为电解质、非电解质 | |
| C. | 凡是含有碳元素的物质为有机物,不含碳元素的物质为无机物 | |
| D. | 根据密度大小把金属分为轻金属和重金属 |
6.电子构型为[Ar]3d54s2的元素是( )
| A. | 过渡元素 | B. | 稀有气体 | C. | 主族元素 | D. | 卤族元素 |
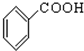
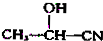 $→_{H_{2}O}^{HCl}$
$→_{H_{2}O}^{HCl}$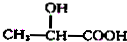
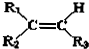 $→_{②Zn/H_{2}O}^{①O}$
$→_{②Zn/H_{2}O}^{①O}$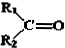 +
+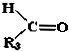
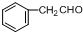 .现有如下转化关系:
.现有如下转化关系: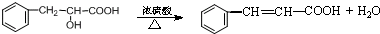 ;反应类型为消去反应;
;反应类型为消去反应;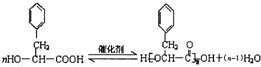 ;
;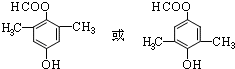 .
.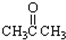 ③CH3CH2Br④
③CH3CH2Br④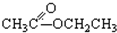 ⑤
⑤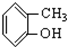 ⑥
⑥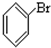 ⑦
⑦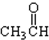 ⑧
⑧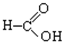 ⑨
⑨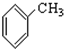 (10))
(10))