题目内容
粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物.进行如下实验:①取适量A进行铝热反应,产物中有单质B生成;②另取20gA全部溶于0.20L4.5mol?L-1的盐酸中,得溶液C;③将①中得到的单质B和溶液C反应,放出1.12L(标准状况)气体,同时生成溶液D,还残留有固体物质B;④用KSCN溶液检验时溶液D不变色,请填空:
(1)①中发生的反应的化学方程式是______.
(2)③中所发生的各反应的离子方程式是______.
(3)若溶液D的体积仍视为0.20L,计算溶液中Mg2+、Fe2+的浓度.
(1)①中发生的反应的化学方程式是______.
(2)③中所发生的各反应的离子方程式是______.
(3)若溶液D的体积仍视为0.20L,计算溶液中Mg2+、Fe2+的浓度.
(1)因铝热反应是铝与Fe2O3反应生成氧化铝和铁,故答案为:2Al+Fe2O3
Al2O3+2Fe
(2)因由信息可知,溶液C中的成分为氯化镁、氯化铁和过量的盐酸,根据步骤③知铁能与盐酸反应,根据步骤④知铁能与氯化铁反应,且反应后产物中不含Fe3+,只有Fe,Fe2+,故答案为:Fe+2H+═Fe2++H2↑,Fe+2Fe3+═3Fe2+
(3)因由20g的A中两种物质(MgO和Fe2O3)的物质的量相等,可推断出两者皆为0.1mol;
0.15L 6mol/L 的盐酸中,HCl物质的量为0.90mol,反应后有0.1molMgCl2,0.2molFeCl3,0.1molHCl.所以n(Mg2+)=0.1mol,
根据步骤四,得到步骤三反应后产物中不含Fe3+,只有Fe,Fe2+,可推断出:单质B(Fe)先与溶液C余下的0.1mol盐酸反应,
Fe+2HCl=FeCl2 +H2↑
0.050.10.05 0.05
则得到0.05mol氯化亚铁,然后所有氯化铁与铁反应:
2FeCl3 +Fe=3FeCl2
0.20.3
因此反应完毕,n(Mg2+ )=0.1mol n(Fe2+ )=0.3+0.05=0.35mol
所以c(Mg2+)=
=0.50mol/L c(Fe2+ )=
=1.75mol/L.
答:Mg2+、Fe2+的浓度分别为:0.50mol/L、1.75mol/L.
| ||
(2)因由信息可知,溶液C中的成分为氯化镁、氯化铁和过量的盐酸,根据步骤③知铁能与盐酸反应,根据步骤④知铁能与氯化铁反应,且反应后产物中不含Fe3+,只有Fe,Fe2+,故答案为:Fe+2H+═Fe2++H2↑,Fe+2Fe3+═3Fe2+
(3)因由20g的A中两种物质(MgO和Fe2O3)的物质的量相等,可推断出两者皆为0.1mol;
0.15L 6mol/L 的盐酸中,HCl物质的量为0.90mol,反应后有0.1molMgCl2,0.2molFeCl3,0.1molHCl.所以n(Mg2+)=0.1mol,
根据步骤四,得到步骤三反应后产物中不含Fe3+,只有Fe,Fe2+,可推断出:单质B(Fe)先与溶液C余下的0.1mol盐酸反应,
Fe+2HCl=FeCl2 +H2↑
0.050.10.05 0.05
则得到0.05mol氯化亚铁,然后所有氯化铁与铁反应:
2FeCl3 +Fe=3FeCl2
0.20.3
因此反应完毕,n(Mg2+ )=0.1mol n(Fe2+ )=0.3+0.05=0.35mol
所以c(Mg2+)=
| 0.1mol |
| 0.20L |
| 0.35mol |
| 0.20L |
答:Mg2+、Fe2+的浓度分别为:0.50mol/L、1.75mol/L.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
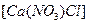 是一种混盐,硫酸铝钾
是一种混盐,硫酸铝钾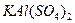 是一种复盐,冰晶石(六氟合铝酸钠)
是一种复盐,冰晶石(六氟合铝酸钠)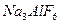 是一种络盐。对于组成为
是一种络盐。对于组成为 的盐可归类于
的盐可归类于