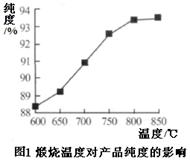
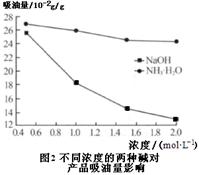
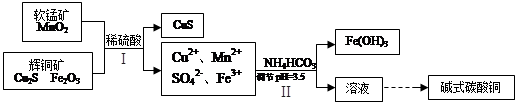题目内容
常温常压下,将一定质量的Fe、Fe2O3、Fe3O4的混合物平均分成两份,一份溶于足量稀硝酸中恰好完全反应,生成0.1 mol NO气体, 将另一份溶于足量稀盐酸中生成一定量气体,向两次反应后溶液中加入硫氰化钾溶液,溶液颜色均无明显变化,则固体溶于盐酸后生成气体的体积为( )
| A.2240mL | B.3360mL | C.3675mL | D.4480mL |
C
试题分析:根据题意可知,反应后的溶液是含有Fe2+的溶液。硝酸与Fe、Fe2O3、Fe3O4的混合物反应产生Fe(NO3)2、NO、H2O。Fe、Fe2O3、Fe3O4的混合物与元素反应产生FeCl2、H2、H2O。假设每一等分含有Fe、Fe2O3、Fe3O4的物质的量分别是a、b、c,则根据电子守恒可得2a=2b+2c+0.1×3;假设产生的氢气的物质的量为x,在另一份中的电子守恒是:2a=2b+2c+2x。2x=0.3.所以x=0.15mol。该气体在标准状况下体积是V=n·Vm=0.15mol×22.4L/mol=3.36L=3360ml,若在常温下,因为温度高于标准状况,所以气体摩尔体积比22.4L/mol略大,所以放出的气体的体积就比3360ml稍微大些,只有C符合题意。故选项是C。

练习册系列答案
相关题目