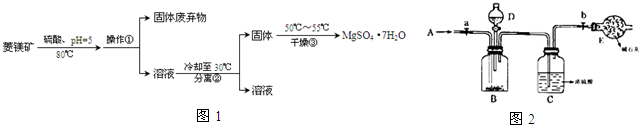
题目内容
12.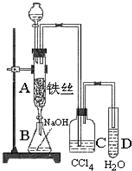 某化学课外小组用如图装置制取溴苯.
某化学课外小组用如图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.
(1)写出A中反应的化学方程式C6H6+Br2$\stackrel{FeBr_{3}}{→}$C6H5Br+HBr.
(2)观察到A中的现象是反应液微沸有红棕色气体充满A容器.
(3)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是除去溶于溴苯中的溴,便于观察溴苯的颜色,写出有关的化学方程式Br2+2NaOH═NaBr+NaBrO+H2O.
(4)C中盛放CCl4的作用是除去溴化氢气体中的溴蒸气.能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明.另一种验证的方法是向试管D中加入石蕊试液,现象是溶液变红色.
分析 (1)苯与溴在溴化铁作用下发生取代反应;
(2)溴与铁反应生成溴化铁,消耗溴,颜色变浅;
(3)溴能与氢氧化钠反应而溴苯不能;
(4)溴化氢气体中混有溴蒸气;如果苯和液溴发生的是取代反应,则有HBr生成,如果发生的是加成反应,则无HBr生成.
解答 解:(1)苯与溴在溴化铁作用下发生取代反应,反应方程式为:C6H6+Br2$\stackrel{FeBr_{3}}{→}$C6H5Br+HBr;
故答案为:C6H6+Br2$\stackrel{FeBr_{3}}{→}$C6H5Br+HBr;
(2)溴与铁反应生成溴化铁,反应现象为:反应液微沸有红棕色气体充满A容器,
故答案为:反应液微沸有红棕色气体充满A容器;
(3)溴单质能与氢氧化钠溶液反应而溴苯不能,反应方程式:Br2+2NaOH═NaBr+NaBrO+H2O;
故答案为:除去溶于溴苯中的溴,便于观察溴苯的颜色;Br2+2NaOH═NaBr+NaBrO+H2O;
(4)CCl4 能溶解溴不能溶解溴化氢,四氯化碳能除去溴化氢气体中的溴蒸气;如果苯和液溴发生的是取代反应,则有HBr生成,如果发生的是加成反应,则无HBr生成.也就是说,如果要证明苯和液溴发生的是取代反应,而不是加成反应,只需检验有无HBr生成,溴化氢与硝酸银反应生成溴化银淡黄色沉淀或在D中加入石蕊试液,若变红则发生取代反应,
故答案为:除去溴化氢气体中的溴蒸气;石蕊试液;溶液变红色.
点评 本题考查苯与溴的取得反应,侧重于学生的分析能力和实验能力的考查,把握实验的原理和方法是解答该题的关键,难度不大.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
1.下列物质的主要成分不是纤维的是( )
| A. | 纯棉布 | B. | 尼龙 | C. | 汽车轮胎 | D. | 晴纶 |
2.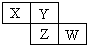 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法正确的是( )
 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法正确的是( )| A. | X的气态氢化物比Y的稳定 | |
| B. | W的最高价氧化物对应水化物的酸性比Z的强 | |
| C. | Z的非金属性比Y的强 | |
| D. | Y的氢化物只有一种 |
7.短周期元素A、B、C、D在周期表中的位置如图所示,B、D最外层电子数之和为12.回答下列问题:
(1)与元素B、D处于同一主族的第2-5周期元素单质分别与H2反应生成1mol气态氢化物对应的热量变化如下,其中能表示该主族第4周期元素的单质生成1mol气态氢化物所对应的热量变化是b(选填字母编号).
a.吸收99.7kJ b.吸收29.7kJ c.放出20.6kJ d.放出241.8kJ
(2)DB2通过下列工艺流程可制化工业原料H2DB4和清洁能源H2.
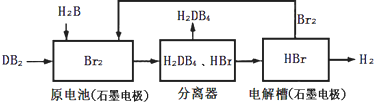
①查得:
试写出通常条件下电解槽中发生总反应的热化学方程式:2HBr(aq)=Br2(aq)+H2(g)△H=+94 kJ/mol
②根据资料:
为检验分离器的分离效果,取分离后的H2DB4溶液于试管,向其中逐滴加入AgNO3溶液至充分反应,若观察到无淡黄色沉淀出现,最终出现白色沉淀,证明分离效果较好.
③在原电池中,负极发生的反应式为SO2+2H2O-2e-=SO42-+4H+.
④在电解过程中,电解槽阴极附近溶液pH变大(填“变大”、“变小”或“不变”).
⑤将该工艺流程用总反应的化学方程式表示为:SO2+2H2O=H2+H2SO4.该生产工艺的优点
有溴可以循环利用,获得清洁能源氢气(答一点即可);缺点有生成过程有有毒物质,电解循环能源消耗大(答一点即可).
(3)溴及其化合物广泛应用于医药、农药、纤维、塑料阻燃剂等,回答下列问题:海水提溴过程中,向浓缩的海水中通入Cl2,将其中的Br-氧化,再用空气吹出溴;然后用碳酸钠溶液吸收溴,溴歧化为Br-和BrO3-,其离子方程式为Br2+6 CO32-+3H2O=5 Br-+BrO3-+6HCO3-.
(4)CuBr2分解的热化学方程式为:2CuBr2(s)=2CuBr(s)+Br2(g)△H=+105.4kJ/mol.在密闭容器中将过量CuBr2于487K下加热分解,平衡时P(Br2)为4.66×103 Pa.
①如反应体系的体积不变,提高反应温度,则p(Br2)将会增大(填“增大”“不变”“减小”).
②如反应温度不变,将反应体系的体积增加一倍,则p(Br2)的变化范围为2.33×103 Pa<p(Br2)≤4.66×103 Pa.
| A | B | |
| C | D |
a.吸收99.7kJ b.吸收29.7kJ c.放出20.6kJ d.放出241.8kJ
(2)DB2通过下列工艺流程可制化工业原料H2DB4和清洁能源H2.

①查得:
| 化学键 | H-H | Br-Br | H-Br |
| 键能(kJ/mol) | 436 | 194 | 362 |
②根据资料:
| 化学式 | Ag2SO4 | AgBr |
| 溶解度(g) | 0.796 | 8.4×10-6 |
③在原电池中,负极发生的反应式为SO2+2H2O-2e-=SO42-+4H+.
④在电解过程中,电解槽阴极附近溶液pH变大(填“变大”、“变小”或“不变”).
⑤将该工艺流程用总反应的化学方程式表示为:SO2+2H2O=H2+H2SO4.该生产工艺的优点
有溴可以循环利用,获得清洁能源氢气(答一点即可);缺点有生成过程有有毒物质,电解循环能源消耗大(答一点即可).
(3)溴及其化合物广泛应用于医药、农药、纤维、塑料阻燃剂等,回答下列问题:海水提溴过程中,向浓缩的海水中通入Cl2,将其中的Br-氧化,再用空气吹出溴;然后用碳酸钠溶液吸收溴,溴歧化为Br-和BrO3-,其离子方程式为Br2+6 CO32-+3H2O=5 Br-+BrO3-+6HCO3-.
(4)CuBr2分解的热化学方程式为:2CuBr2(s)=2CuBr(s)+Br2(g)△H=+105.4kJ/mol.在密闭容器中将过量CuBr2于487K下加热分解,平衡时P(Br2)为4.66×103 Pa.
①如反应体系的体积不变,提高反应温度,则p(Br2)将会增大(填“增大”“不变”“减小”).
②如反应温度不变,将反应体系的体积增加一倍,则p(Br2)的变化范围为2.33×103 Pa<p(Br2)≤4.66×103 Pa.
4.一定条件下的密闭容器内发生4NH3+5O2?4NO+6H2O的反应,下列反应速率关系正确的是( )
| A. | V${\;}_{N{H}_{3}}$=$\frac{4}{5}$V${\;}_{{O}_{2}}$ | B. | V${\;}_{N{H}_{3}}$=V${\;}_{{O}_{2}}$=V${\;}_{{H}_{2}O}$ | ||
| C. | V${\;}_{{O}_{2}}$=$\frac{4}{5}$VNO | D. | V${\;}_{{O}_{2}}$=$\frac{6}{5}$V${\;}_{{H}_{2}O}$ |
2.下列物质属于共价化合物的是( )
| A. | C60 | B. | CaCl2 | C. | KF | D. | C4H10 |