题目内容
9.(1)室温下取0.2mol•L-1HCl溶液与0.2mol•L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:①混合溶液中水电离出的c(H+)>0.2mol•L-1 HCl溶液中水电离出的c(H+);(填“>”、“<”、或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Cl-)-c(M+)=9.9×10-7 mol•L-1 c(H+)-c(MOH)=10-7 mol•L-1
(2)室温下如果取0.2mol•L-1 MOH溶液与0.1mol•L-1 HCl溶液等体积混合,测得混合溶液的pH<7,则说明MOH的电离程度<MCl的水解程度.(填“>”、“<”、或“=”),溶液中各离子浓度由大到小的顺序为c(Cl-)>c(M+)>c(H+)>c(OH-).
(3)已知t℃时,Kw=1×10-13,则t℃>25℃(填“>”、“<”或“=”).在t℃时将pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则 $\frac{a}{b}$=$\frac{9}{2}$.
分析 (1)①等物质的量浓度等体积的HCl、MOH混合,二者恰好反应生成MCl,MCl为强酸弱碱盐,阳离子水解导致溶液呈酸性;
酸或碱抑制水电离,含有弱离子的盐促进水电离;
②任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Cl-)-c(M+)=c(H+)-c(OH-);
溶液中存在物料守恒,根据物料守恒得c(Cl-)=c(M+)+c(MOH),根据物料守恒和电荷守恒计算c(H+)-c(MOH);
(2)室温下如果取0.2mol•L-1 MOH溶液与0.1mol•L-1 HCl溶液等体积混合,碱物质的量是酸二倍,则溶液中溶质为MCl、MOH,测得混合溶液的pH<7,溶液呈酸性,说明MCl水解程度大于MOH电离程度;
混合溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒判断c(Cl-)、c(M+)相对大小;
(3)水的电离是吸热反应,升高温度促进水电离,导致Kw增大;在t℃时将pH=11的NaOH溶液中c(OH-)=0.01mol/L,pH=1的硫酸溶液中c(H+)=0.1mol/L,混合溶液pH=2,则混合溶液中c(H+)=0.01mol/L,
混合溶液中c(H+)=$\frac{0.1mol/L×bL-0.01mol/L×aL}{(a+b)L}$.
解答 解:(1)①等物质的量浓度等体积的HCl、MOH混合,二者恰好反应生成MCl,MCl为强酸弱碱盐,阳离子水解导致溶液呈酸性;
酸或碱抑制水电离,含有弱离子的盐促进水电离,所以混合溶液中水电离出的c(H+)>0.2mol•L-1 HCl溶液中水电离出的c(H+),故答案为:>;
②任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Cl-)-c(M+)=c(H+)-c(OH-)=10-6mol•L-1-10-8mol•L-1=9.9×10-7mol•L-1;
溶液中存在物料守恒,根据物料守恒得c(Cl-)=c(M+)+c(MOH),根据物料守恒和电荷守恒计算c(H+)-c(MOH)=c(OH-)=10-8mol•L-1;
故答案为:9.9×10-7;10-8;
(2)室温下如果取0.2mol•L-1 MOH溶液与0.1mol•L-1 HCl溶液等体积混合,碱物质的量是酸二倍,则溶液中溶质为MCl、MOH,测得混合溶液的pH<7,溶液呈酸性,说明MCl水解程度大于MOH电离程度;
混合溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒得c(Cl-)>c(M+),盐类水解较微弱,所以c(M+)>c(H+),则溶液中离子浓度大小顺序是c(Cl-)>c(M+)>c(H+)>c(OH-),
故答案为:<;c(Cl-)>c(M+)>c(H+)>c(OH-);
(3)水的电离是吸热反应,升高温度促进水电离,导致Kw增大,t℃时,Kw=1×10-13>1×10-14,则t℃>25℃;
在t℃时将pH=11的NaOH溶液中c(OH-)=0.01mol/L,pH=1的硫酸溶液中c(H+)=0.1mol/L,混合溶液pH=2,则混合溶液中c(H+)=0.01mol/L,
混合溶液中c(H+)=$\frac{0.1mol/L×bL-0.01mol/L×aL}{(a+b)L}$=0.01mol/L,a:b=9:2,
故答案为:>;$\frac{9}{2}$.
点评 本题考查酸碱混合溶液定性判断、离子浓度大小比较等知识点,侧重考查学生分析判断能力,注意电荷守恒及物料守恒的灵活运用,水的离子积常数只与温度有关,与溶液酸碱性无关,题目难度不大.

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案| A. | 标准状况下22.4L CH4 | B. | 28g N2( N2的摩尔质量为28g/mol ) | ||
| C. | 1.5mol H2O | D. | 6.02×1023个NH3 |
| A. | 阳极:Cu-2e-═Cu2+ 阴极:Cu2++2e-═Cu | |
| B. | 阳极:2Cu+2I--2e-═2CuI 阴极:2H++2e-═H2↑ | |
| C. | 阳极:2I--2e-═I2 阴极:2H++2e-═H2↑ | |
| D. | 阳极:4OH--4e-═2H2O+O2↑ 阴极:4H++4e-═2H2↑ |
| A. | 纯棉布 | B. | 尼龙 | C. | 汽车轮胎 | D. | 晴纶 |
| A. | 使燃料充分燃烧 | B. | 加大能源开采力度 | ||
| C. | 加强能源利用的科技投入 | D. | 合理使用能源 |
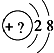 某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断.
某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断. ;
;