题目内容
4.下列排列顺序不正确的是( )| A. | 原子半径:K>Na>S>O | B. | 离子半径:Na+>Mg2+>O2->F- | ||
| C. | 酸性:H2SO4>H3PO4>H2SiO3 | D. | 碱性:KOH>Ca(OH)2>Mg(OH)2 |
分析 A.同周期自左而右原子半径减小,同主族自上而下原子半径增大;
B.电子层结构相同的离子,核电荷数越大离子半径越小;
C.非金属性越强,最高价含氧酸的酸性越强;
D.金属性越强,最高价氧化物对应水化物的碱性越强.
解答 解:A.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:K>Na>S>O,故A正确;
B.电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:O2->F->Na+>Mg2+>O2->F-,故B错误;
C.非金属性S>P>Si,非金属性越强,最高价含氧酸的酸性越强,故酸性:H2SO4>H3PO4>H2SiO3,故C正确;
D.金属性K>Ca>Mg,金属性越强,最高价氧化物对应水化物的碱性越强,故碱性:KOH>Ca(OH)2>Mg(OH)2,故D正确,
故选B.
点评 本题考查元素周期律的应用,难度不大,明确规律即可解答,注意微粒半径比较,有利于基础知识的巩固.

练习册系列答案
相关题目
14.下列物质中属于有机物的是( )
①氰化钠(NaCN) ②丙酮 ③丁炔 ④碳化硅(SiC) ⑤碳酸 ⑥CO ⑦KSCN.
①氰化钠(NaCN) ②丙酮 ③丁炔 ④碳化硅(SiC) ⑤碳酸 ⑥CO ⑦KSCN.
| A. | ①②③④⑦ | B. | ①②③ | C. | ②③ | D. | 全部都是 |
15.下列化合物中不含离子键的是( )
| A. | Na2O | B. | HCl | C. | CaCl2 | D. | Na2CO3 |
9.半导体工业用石英砂做原料通过以下三个主要反应生产纯硅:
Si(s)(石英砂)+2C(s)═Si(s)(粗硅)+2CO(g)△H=+682.44kJ/mol
Si(s)(粗硅)+2Cl2(s)═SiCl4(g),△H=-657.01kJ/mol
SiCl4(g)+2Mg(s)═2MgCl2(s)+Si(s)(纯硅),△H=-625.63kJ/mol
则生产56.00g纯硅的反应热为( )
Si(s)(石英砂)+2C(s)═Si(s)(粗硅)+2CO(g)△H=+682.44kJ/mol
Si(s)(粗硅)+2Cl2(s)═SiCl4(g),△H=-657.01kJ/mol
SiCl4(g)+2Mg(s)═2MgCl2(s)+Si(s)(纯硅),△H=-625.63kJ/mol
则生产56.00g纯硅的反应热为( )
| A. | 600.20 kJ•mol-1 | B. | +1200.40 kJ•mol-1 | ||
| C. | -1965.08 kJ•mol-1 | D. | -1200.40 kJ•mol-1 |
13.PH3(膦)分子空间构型是三角锥形,以下关于PH3的叙述中,正确的是( )
| A. | PH3是非极性分子 | B. | PH3分子中的P-H 键是非极性键 | ||
| C. | PH3中心原子杂化轨道类型为sp2型 | D. | PH3分子中有未成键的电子对 |
14.下列离子方程式属于盐的水解,且书写正确的是( )
| A. | NaHCO3溶液:HCO3-+H2O?CO32-+H3O+ | |
| B. | NaHS溶液:HS-+H2O?H2S+OH- | |
| C. | Na2CO3溶液:CO32-+2H2O?H2CO3+2OH- | |
| D. | Cl2溶于H2O中:Cl2+H2O═H++Cl-+HClO |
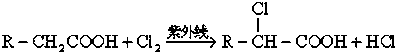 ,
,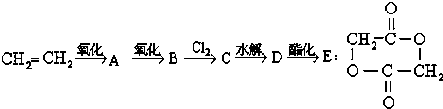
 +2H2O.
+2H2O.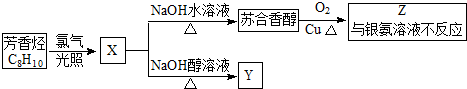
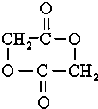
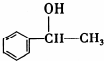 ,它不能发生的有机反应类型有④、⑥.
,它不能发生的有机反应类型有④、⑥.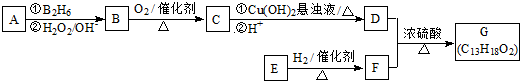
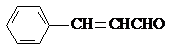 .
.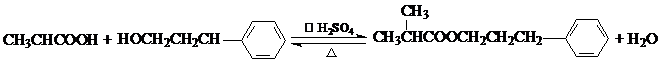 .
.